解题方法
1 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。基态F原子的电子有___________ 种空间运动状态。
(2)氟氧化物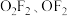 的结构已经确定。
的结构已经确定。
①依据上表数据推测 键的稳定性:
键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中
中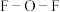 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,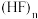 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用蒬石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
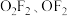 的结构已经确定。
的结构已经确定。 |  | |
 键长/pm 键长/pm | 121 | 148 |
 键的稳定性:
键的稳定性:
 (填“>”或“<”)。
(填“>”或“<”)。②
 中
中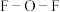 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键
 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,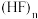 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:②
 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用蒬石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2 . 铜及其化合物在生产和生活中有着广泛的应用。
(1)Cu在元素周期表中的位置为______ 。
(2)基态铜原子有______ 种运动状态不同的电子。
(3)原子核外电子的两种自旋状态分别用+ 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为______ 。
(4)Cu+比Cu2+更稳定的原因是_______ 。
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
(5)步骤I中反应的离子方程式为________ ;_______ 。
(6)H-N-H键角大小:[Cu(NH3)4]2+_______ NH3(填“>”、“=”或“<”),其原因是_______ 。
(7)该实验能说明,Cu2+与NH3的结合能力_______ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是______ 。
(1)Cu在元素周期表中的位置为
(2)基态铜原子有
(3)原子核外电子的两种自旋状态分别用+
 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为(4)Cu+比Cu2+更稳定的原因是
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| I | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| Ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| Ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为[Cu(NH3)4]SO4 H2O H2O |
| Ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
(5)步骤I中反应的离子方程式为
(6)H-N-H键角大小:[Cu(NH3)4]2+
(7)该实验能说明,Cu2+与NH3的结合能力
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是
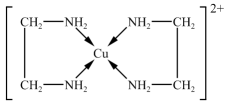
| A.该离子的配位数是4 |
| B.该离子的配体数是4 |
| C.形成配离子前后,Cu的化合价不变 |
| D.该离子中含有离子键、非极性键与极性键 |
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(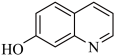 )、6−羟基喹啉(
)、6−羟基喹啉(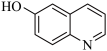 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
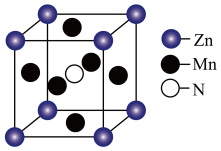
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
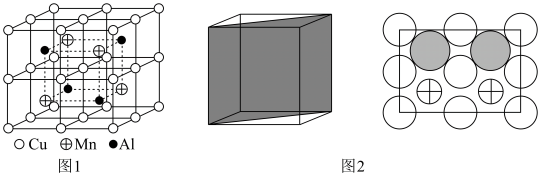
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.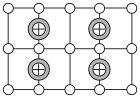 | B.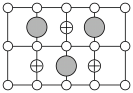 |
C. | D.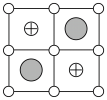 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
4 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
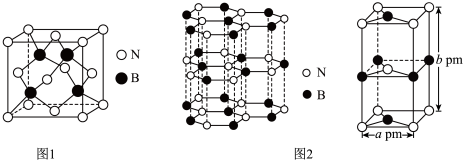
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为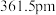 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为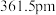 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
423次组卷
|
3卷引用:青海省海南州贵德高级中学2023-2024学年高三下学期开学理综试题-高中化学
23-24高二下·全国·课前预习
解题方法
5 . 苯的分子结构
(1)分子式为_______ ,结构简式为 和
和 ,为
,为_______ 结构。
(2)化学键形成
苯分子中的6个碳原子均采取_______ 杂化,分别与氢原子及相邻碳原子以_______ 键结合,键间夹角均为120°,连接成六元环。每个碳碳键的键长相等,都是139 pm,介于______ 和______ 的键长之间。每个碳原子余下的_______ 轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大_______ 键,均匀地对称分布在苯环平面的上下两侧。
(1)分子式为
 和
和 ,为
,为(2)化学键形成
苯分子中的6个碳原子均采取
您最近一年使用:0次
6 .  是周期表中
是周期表中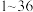 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
(1) 的电子式为
的电子式为______________ , 中含有的化学键类型为
中含有的化学键类型为______________ .
(2)B、C两种元素的第三电离能由大到小的顺序为______________ (填元素符号)
(3)E在元素周期表中位置为______________ ,位于元素周期表的______________ 区.
(4)比较:①键角大小: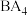
______________  ;②在水中的溶解性大小
;②在水中的溶解性大小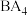
______________  ;
;
 是周期表中
是周期表中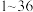 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.(1)
 的电子式为
的电子式为 中含有的化学键类型为
中含有的化学键类型为(2)B、C两种元素的第三电离能由大到小的顺序为
(3)E在元素周期表中位置为
(4)比较:①键角大小:
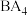
 ;②在水中的溶解性大小
;②在水中的溶解性大小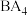
 ;
;
您最近一年使用:0次
名校
解题方法
7 . 完成下列问题。
(1)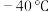 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为________ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式____ ;为 键角
键角____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②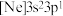 、③
、③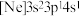 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。
(1)
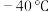 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②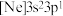 、③
、③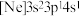 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。| A.微粒半径:③>①>② | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次
名校
8 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
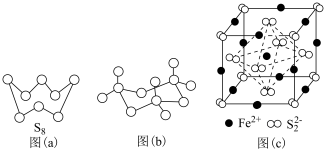
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近一年使用:0次
2024-01-15更新
|
147次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
21-22高二下·全国·单元测试
解题方法
9 . 回答下列问题:
(1)在BBr3分子中,Br-B-Br的键角是_____ 。
(2)羰基硫(COS)与CO2的结构相似,羰基硫(COS)分子的结构式为______ ;光气(COCl2)各原子最外层都满足8电子稳定结构,则光气分子的空间构型为______ (用文字描述)。
(3)NO 的立体构型是
的立体构型是_____ 。
(4)KNO3中NO 的空间构型为
的空间构型为______ ,写出与NO 结构相同的一种阴离子的化学式
结构相同的一种阴离子的化学式_____ 。
(5)用价层电子对互斥模型推断SnBr2分子中Sn-Br键的键角_____ 120°(填“>”“<”或“=”)。
(1)在BBr3分子中,Br-B-Br的键角是
(2)羰基硫(COS)与CO2的结构相似,羰基硫(COS)分子的结构式为
(3)NO
 的立体构型是
的立体构型是(4)KNO3中NO
 的空间构型为
的空间构型为 结构相同的一种阴离子的化学式
结构相同的一种阴离子的化学式(5)用价层电子对互斥模型推断SnBr2分子中Sn-Br键的键角
您最近一年使用:0次
解题方法
10 . 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(2)石墨烯(指单层石墨)中碳原子的杂化形式_______ 。
(3)C60属于_______ 晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有_______ 键。
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为_______ g·cm-3(列出计算式即可)。
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_______ 。
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是_______ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有_______ mol配位键。

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为
(2)石墨烯(指单层石墨)中碳原子的杂化形式
(3)C60属于
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有
您最近一年使用:0次
2022-10-24更新
|
660次组卷
|
2卷引用:黑龙江省饶河县高级中学2021-2022学年高二下学期第一次月考化学试题



