名校
解题方法
1 . [Cu(NH3)4]SO4·H2O 晶体制备:
(1)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到___________ 色的透明溶液;再加入适量乙醇,将析出[Cu(NH3)4]SO4·H2O 晶体。请解释加入乙醇后析出晶体的原因___________ 。
(2)写出沉淀溶解得透明溶液的离子方程式___________ 。
(3)以配位键形式表示[Cu(NH3)4]2+的结构___________ ,1 mol[Cu(NH3)4]2+含有___________ 个σ键。
(4)[Cu (NH3)4]SO4 中,存在的化学键类型有___________ (填选项)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)从结构的角度分析 NH3比 NF3的键角大的原因:___________ 。
(1)制备过程:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到
(2)写出沉淀溶解得透明溶液的离子方程式
(3)以配位键形式表示[Cu(NH3)4]2+的结构
(4)[Cu (NH3)4]SO4 中,存在的化学键类型有
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)从结构的角度分析 NH3比 NF3的键角大的原因:
您最近一年使用:0次
20-21高二·全国·课时练习
2 . A、B、C、D、E五种元素原子序数依次增大,A元素原子的价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol-1):
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显___________ 价,D显___________ 价。
(2)某气态单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个___________ 键,2个___________ 键。
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是___________ 。
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
(2)某气态单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是
| 单键 | 双键 | 叁键 | |
| AB键能/(kJ·mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲键能/(kJ·mol-1) | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
解题方法
3 . 三种常见元素原子的结构信息如表所示,试回答下列问题。
(1)C元素位于元素周期表中______ 区,C元素原子的价电子排布式为______ 。
(2)A的简单氢化物分子结合一个H形成阳离子后,其键角______ (填“变大”“变小”或“不变”)。
(3)下列分子结构图中“●”表示某种元素的原子,①中“●”表示A元素的原子,②③中“●”表示的原子其元素与A元素同周期,④中“●”表示的原子其元素与B元素同主族且与A元素同周期,“○”均表示氢原子,小黑点“·”均表示没有参与形成共价键的电子,短线均表示共价键。

上述四种物质的分子式分别为______ 、______ 、______ 、______ ,中心原子采取sp3杂化的是______ (填序号)。
| 元素 | A | B | C |
| 结构信息 | 原子核外有2个电子层,最外层有3个未成对电子 | 原子核外M层有1个成对的p电子 | 原子核外M层充满电子,N层有1个未成对的s电子 |
(2)A的简单氢化物分子结合一个H形成阳离子后,其键角
(3)下列分子结构图中“●”表示某种元素的原子,①中“●”表示A元素的原子,②③中“●”表示的原子其元素与A元素同周期,④中“●”表示的原子其元素与B元素同主族且与A元素同周期,“○”均表示氢原子,小黑点“·”均表示没有参与形成共价键的电子,短线均表示共价键。

上述四种物质的分子式分别为
您最近一年使用:0次
名校
解题方法
4 . 据《科技日报》报道,我国科学家研制出一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为___________ 。
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是___________ (填元素符号)。
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为___________ 。
(4)石墨烯限域单原子铁能活化 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力___________ (填“增强”或“减弱”)。
(5)常温下,在催化剂作用下, 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。
①它们的沸点由高到低的顺序为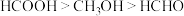 ,主要原因是
,主要原因是___________ 。
② 和
和 相比,键角较大的是
相比,键角较大的是___________ ,主要原因是___________ 。
 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为
(4)石墨烯限域单原子铁能活化
 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力(5)常温下,在催化剂作用下,
 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。①它们的沸点由高到低的顺序为
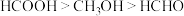 ,主要原因是
,主要原因是②
 和
和 相比,键角较大的是
相比,键角较大的是
您最近一年使用:0次
2021-02-16更新
|
450次组卷
|
4卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 章末综合检测卷
5 . Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于 区,最外层没有单电子,其余的均为短周期主族元素;
区,最外层没有单电子,其余的均为短周期主族元素;
②基态Y原子的价电子排布式为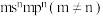 ;
;
③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的 能级有1个单电子。
能级有1个单电子。
请回答下列问题:
(1)Z在周期表中的位置为______ 。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为______ (用对应元素的符号填写)。
(3)分析下表中两种物质的键能数据(单位: )。
)。
结合数据说明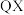 比
比 活泼的原因:
活泼的原因:__________________ 。
①Z位于
 区,最外层没有单电子,其余的均为短周期主族元素;
区,最外层没有单电子,其余的均为短周期主族元素;②基态Y原子的价电子排布式为
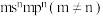 ;
;③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的
 能级有1个单电子。
能级有1个单电子。请回答下列问题:
(1)Z在周期表中的位置为
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为
(3)分析下表中两种物质的键能数据(单位:
 )。
)。 |  |  | |
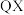 | 351 | 745 | 1076 |
 | 196 | 418 | 945 |
 比
比 活泼的原因:
活泼的原因:
您最近一年使用:0次
解题方法
6 . 磷化硼是一种典型的超硬无机材料,常以 、
、 为原料制备。回答下列问题:
为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___________ 。
(2)与 分子互为等电子体的一种离子为
分子互为等电子体的一种离子为___________ (填化学式)。
(3) 分子的空间结构为
分子的空间结构为___________ ; 的沸点
的沸点___________ (填“高于”或“低于”) ,理由是
,理由是___________ 。
(4) 、
、 和
和 三种分子中键角由大到小的顺序为
三种分子中键角由大到小的顺序为___________ 。
(5) 可转化为硼酸,硼酸为一元弱酸的原因是
可转化为硼酸,硼酸为一元弱酸的原因是______ (用离子方程式表示)。
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)_______

 、
、 为原料制备。回答下列问题:
为原料制备。回答下列问题:(1)基态P原子与B原子中未成对电子数之比为
(2)与
 分子互为等电子体的一种离子为
分子互为等电子体的一种离子为(3)
 分子的空间结构为
分子的空间结构为 的沸点
的沸点 ,理由是
,理由是(4)
 、
、 和
和 三种分子中键角由大到小的顺序为
三种分子中键角由大到小的顺序为(5)
 可转化为硼酸,硼酸为一元弱酸的原因是
可转化为硼酸,硼酸为一元弱酸的原因是(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)

您最近一年使用:0次
7 . (1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___ (填元素符号)。
②CH3COOH中C原子轨道杂化类型为___ ;1 mol CH3COOH分子含有σ键的数目为___ 。
(2)CS2分子中,C原子的杂化轨道类型是____ ,写出两个与CS2具有相同空间构型和键合形式的离子____ 。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
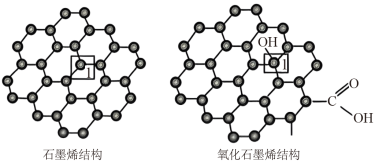
氧化石墨烯中,1号C的杂化方式是____ ,该C与相邻C形成的C-C键角____ (填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是
②CH3COOH中C原子轨道杂化类型为
(2)CS2分子中,C原子的杂化轨道类型是
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。

氧化石墨烯中,1号C的杂化方式是
您最近一年使用:0次
2019-04-21更新
|
99次组卷
|
2卷引用:(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷



