名校
解题方法
1 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
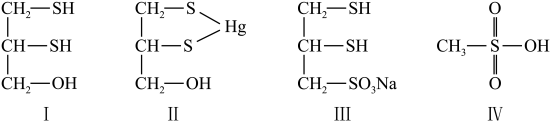
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近半年使用:0次
名校
2 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
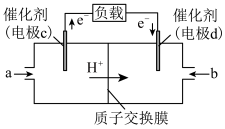
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近半年使用:0次
名校
解题方法
3 . 硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
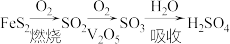
(1)基态 原子核外未成对电子数为
原子核外未成对电子数为_______ , 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为_______ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______ 键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(3) 分子的空间构型为
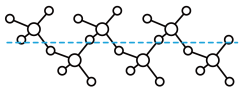
分子的空间构型为_______ 。固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是_______ (填“桥氧”或“端基氧”)。
(4)绿矾是一种重要的硫酸盐,其组成可写成 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。
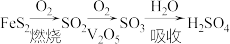
(1)基态
 原子核外未成对电子数为
原子核外未成对电子数为 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)
 分子的空间构型为
分子的空间构型为 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
(4)绿矾是一种重要的硫酸盐,其组成可写成
 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近半年使用:0次
4 . 我国科学家在《NationalScienceReview》上报道了具有特殊稳定性的类钙钛矿结构中性团簇Co13O8,理论研究表明该团簇具有独特的立方芳香性。这类新型的氧钝化金属团簇有望用作基因新材料,研究人员将其命名为“金属氧立方”。回答下列问题:
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图_______ 。
(2)辉砷钴矿(主要成分为CoAsS)是一种常见的钴矿石。
①CoAsS中三种元素的电负性大小关系为_______ 。O、S的简单氢化物分子键角从大到小的顺序及原因是_______ 。
②砷的硫化物有多种,有一种硫化砷的结构为 ,则该分子中发生sp3杂化的元素有
,则该分子中发生sp3杂化的元素有_______ 种;还有一种线型结构As2S2,该分子中各原子均达到8电子稳定结构,As2S2的电子式为_______ 。
(3)钴离子极易形成配合物,如[Co(NH3)6](NO3)3,与NH3互为等电子体的阳离子有_______ (任写一种), 中的大π键为
中的大π键为_______ 。
(4)钴的一种化合物晶胞结构如下图所示:

①晶胞中,Co原子位于O原子构成的_______ 空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3,则晶胞中Ti与O的最近距离是_______ nm(用含ρ、NA的代数式表示)。
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图
(2)辉砷钴矿(主要成分为CoAsS)是一种常见的钴矿石。
①CoAsS中三种元素的电负性大小关系为
②砷的硫化物有多种,有一种硫化砷的结构为
 ,则该分子中发生sp3杂化的元素有
,则该分子中发生sp3杂化的元素有(3)钴离子极易形成配合物,如[Co(NH3)6](NO3)3,与NH3互为等电子体的阳离子有
 中的大π键为
中的大π键为(4)钴的一种化合物晶胞结构如下图所示:

①晶胞中,Co原子位于O原子构成的
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3,则晶胞中Ti与O的最近距离是
您最近半年使用:0次
名校
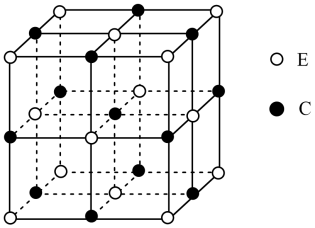
5 . 元素A、B、C、D、E、F、G在元素周期表中的位置如图所示,回答下列问题:

(1)G的基态原子核外电子排布式为____ 。原子的第一电离能:D____ E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是____ 。
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于____ 晶体,该物质中存在的化学键类型有___ 。
(4)化合物BCF2的立体构型为____ ,其中B原子的杂化轨道类型是____ 。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。列式计算EC晶体的密度(g·cm-3)____ 。

(1)G的基态原子核外电子排布式为
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(4)化合物BCF2的立体构型为
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。列式计算EC晶体的密度(g·cm-3)

您最近半年使用:0次
名校
解题方法
6 . S元素是动植物生长所必需的元素,在生活中应用广泛。
(1)基态S原子的价电子排布式为___________ 。
(2) 的空间构型为
的空间构型为___________ , 的键角由大到小的顺序为
的键角由大到小的顺序为___________ (填化学式)。
(3)用杂化轨道理论解释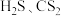 的键角差别很大的原因是
的键角差别很大的原因是___________ 。从结构的角度解释 的酸性比
的酸性比 强的原因是
强的原因是___________ 。
(4) 结构有两种,硫氰酸
结构有两种,硫氰酸 的沸点
的沸点___________ (填“高于”或“低于”)异硫氰酸。
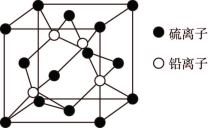
(5) 晶胞如图所示,
晶胞如图所示, 填在由
填在由 形成的
形成的___________ 空隙中。已知晶胞中 与
与 最近的距离为
最近的距离为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体密度为
,则晶体密度为___________  。
。
(6)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
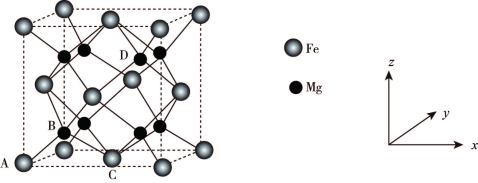
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部原子的相对位置,其中原子坐标参数A为 ,B为
,B为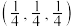 ,C为
,C为 ,则D点坐标参数为
,则D点坐标参数为___________ 。
(1)基态S原子的价电子排布式为
(2)
 的空间构型为
的空间构型为 的键角由大到小的顺序为
的键角由大到小的顺序为(3)用杂化轨道理论解释
 的键角差别很大的原因是
的键角差别很大的原因是 的酸性比
的酸性比 强的原因是
强的原因是(4)
 结构有两种,硫氰酸
结构有两种,硫氰酸 的沸点
的沸点(5)
 晶胞如图所示,
晶胞如图所示, 填在由
填在由 形成的
形成的 与
与 最近的距离为
最近的距离为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体密度为
,则晶体密度为 。
。
(6)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ,B为
,B为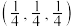 ,C为
,C为 ,则D点坐标参数为
,则D点坐标参数为
您最近半年使用:0次
名校
解题方法
7 . 2021年7月4日,“神舟十二号”航天员圆满完成出舱任务。“神舟十二号”制作材料中包含了 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1) 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ , 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为___________ 。
(2) 位于元素周期表的
位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是___________ 。
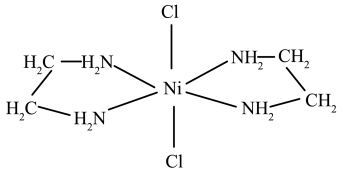
(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有___________ 个,该整合物中C的杂化方式为___________ 。
 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(2)
 位于元素周期表的
位于元素周期表的 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有
您最近半年使用:0次
8 . B、N、O、Fe、Co、Zn等元素及其化合物是生活和工业的重要材料。
(1)上述6种元素在元素周期表中位于ds区的元素有__ 。(填元素符号)
(2)原子中运动电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为___ 。
(3)自然界中不存在单质硼,主要存在的是硼的氧化物,从键能角度分析其原因是___ 。
(4)肼(N2H4)可视为NH3分子中的一个氢原子被—NH2取代形成的。肼可用作火箭燃料,其燃烧反应是:N2O4+2N2H4=3N2+4H2O,若该反应中生成3molπ键,则断裂的N—H键有__ mol。
(5)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,该分子中铁的价电子排布式为__ ,该分子中氧的化合价有__ ,该分子的结构示意图为___ 。
(6)钴(Co)可形成分子式为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5BrSO4],往其溶液中加BaCl2溶液时,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为__ 。
(1)上述6种元素在元素周期表中位于ds区的元素有
(2)原子中运动电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为(3)自然界中不存在单质硼,主要存在的是硼的氧化物,从键能角度分析其原因是
(4)肼(N2H4)可视为NH3分子中的一个氢原子被—NH2取代形成的。肼可用作火箭燃料,其燃烧反应是:N2O4+2N2H4=3N2+4H2O,若该反应中生成3molπ键,则断裂的N—H键有
(5)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,该分子中铁的价电子排布式为
(6)钴(Co)可形成分子式为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5BrSO4],往其溶液中加BaCl2溶液时,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为
您最近半年使用:0次
名校
9 . 中国医学工作者曾因“硒与克山病”和“硒预防肝癌研究”的突破性科研成果而两次获得由国际生物无机化学家协会颁发的“施瓦茨奖”。请回答下列问题:
(1)基态Se原子的价电子排布图为_______ ,Se与其同周期且相邻的两种元素的第一电离能由大到小的顺序为_______ (用元素符号表示)。
(2)SeO2与水反应能生成H2SeO3,H2SeO3中Se原子的杂化轨道类型为_______ ,H2SeO3与H2SO3相比酸性较强的是_______ (填化学式)。
(3)SeO3属于_______ (填“极性”或“非极性”)分子。SeO3与SeO2相比,O-Se-O键角较大的是_______ (填化学式),原因为_______ 。
(4)一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:

①该化合物的化学式为_______ ;
②若晶胞密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中距离最近的两个Se原子的核间距为_______ pm。
(1)基态Se原子的价电子排布图为
(2)SeO2与水反应能生成H2SeO3,H2SeO3中Se原子的杂化轨道类型为
(3)SeO3属于
(4)一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:

①该化合物的化学式为
②若晶胞密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中距离最近的两个Se原子的核间距为
您最近半年使用:0次
2021-12-22更新
|
325次组卷
|
2卷引用:河北省邯郸市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
10 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第___________ 族___________ 区,价电子排布式为___________ 。
(2)比较Z和W第一电离能的大小:Z___________ (填“>”“=”或“<”)W,请用物质结构的知识解释:___________ 。
(3)离子ZW 的空间结构为:
的空间结构为:___________ ;化合物X2W的价层电子对互斥模型为___________ 。
(4)比较ZX 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
___________ (填“>”“=”或“<”)ZX3,请用价层电子对互斥理论解释:___________ 。
(5)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有___________ ,该化合物中σ键和π键的个数之比为___________ 。
| X元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层电子 |
| Z元素基态原子的未成对电子数目是同周期最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)比较Z和W第一电离能的大小:Z
(3)离子ZW
 的空间结构为:
的空间结构为:(4)比较ZX
 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
(5)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有
您最近半年使用:0次
2021-12-02更新
|
386次组卷
|
2卷引用:浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题



