名校
解题方法
1 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
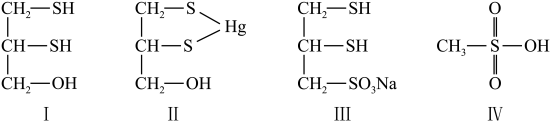
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
名校
解题方法
2 . 硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
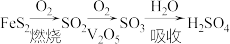
(1)基态 原子核外未成对电子数为
原子核外未成对电子数为_______ , 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为_______ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______ 键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(3) 分子的空间构型为
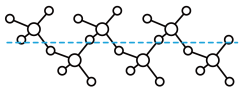
分子的空间构型为_______ 。固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是_______ (填“桥氧”或“端基氧”)。
(4)绿矾是一种重要的硫酸盐,其组成可写成 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。
(1)基态
 原子核外未成对电子数为
原子核外未成对电子数为 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)
 分子的空间构型为
分子的空间构型为 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
(4)绿矾是一种重要的硫酸盐,其组成可写成
 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次
名校
解题方法
3 . S元素是动植物生长所必需的元素,在生活中应用广泛。
(1)基态S原子的价电子排布式为___________ 。
(2) 的空间构型为
的空间构型为___________ , 的键角由大到小的顺序为
的键角由大到小的顺序为___________ (填化学式)。
(3)用杂化轨道理论解释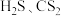 的键角差别很大的原因是
的键角差别很大的原因是___________ 。从结构的角度解释 的酸性比
的酸性比 强的原因是
强的原因是___________ 。
(4) 结构有两种,硫氰酸
结构有两种,硫氰酸 的沸点
的沸点___________ (填“高于”或“低于”)异硫氰酸。
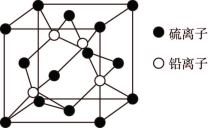
(5) 晶胞如图所示,
晶胞如图所示, 填在由
填在由 形成的
形成的___________ 空隙中。已知晶胞中 与
与 最近的距离为
最近的距离为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体密度为
,则晶体密度为___________  。
。
(6)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
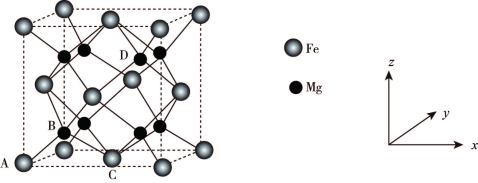
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部原子的相对位置,其中原子坐标参数A为 ,B为
,B为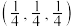 ,C为
,C为 ,则D点坐标参数为
,则D点坐标参数为___________ 。
(1)基态S原子的价电子排布式为
(2)
 的空间构型为
的空间构型为 的键角由大到小的顺序为
的键角由大到小的顺序为(3)用杂化轨道理论解释
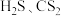 的键角差别很大的原因是
的键角差别很大的原因是 的酸性比
的酸性比 强的原因是
强的原因是(4)
 结构有两种,硫氰酸
结构有两种,硫氰酸 的沸点
的沸点(5)
 晶胞如图所示,
晶胞如图所示, 填在由
填在由 形成的
形成的 与
与 最近的距离为
最近的距离为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体密度为
,则晶体密度为 。
。
(6)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ,B为
,B为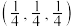 ,C为
,C为 ,则D点坐标参数为
,则D点坐标参数为
您最近一年使用:0次
名校
解题方法
4 . 2021年7月4日,“神舟十二号”航天员圆满完成出舱任务。“神舟十二号”制作材料中包含了 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1) 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ , 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为___________ 。
(2) 位于元素周期表的
位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是___________ 。
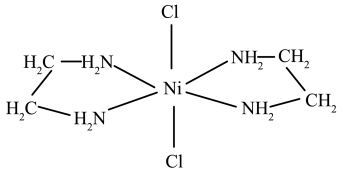
(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有___________ 个,该整合物中C的杂化方式为___________ 。
 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(2)
 位于元素周期表的
位于元素周期表的 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有
您最近一年使用:0次
名校
解题方法
5 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第___________ 族___________ 区,价电子排布式为___________ 。
(2)比较Z和W第一电离能的大小:Z___________ (填“>”“=”或“<”)W,请用物质结构的知识解释:___________ 。
(3)离子ZW 的空间结构为:
的空间结构为:___________ ;化合物X2W的价层电子对互斥模型为___________ 。
(4)比较ZX 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
___________ (填“>”“=”或“<”)ZX3,请用价层电子对互斥理论解释:___________ 。
(5)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有___________ ,该化合物中σ键和π键的个数之比为___________ 。
| X元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层电子 |
| Z元素基态原子的未成对电子数目是同周期最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)比较Z和W第一电离能的大小:Z
(3)离子ZW
 的空间结构为:
的空间结构为:(4)比较ZX
 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
(5)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有
您最近一年使用:0次
2021-12-02更新
|
387次组卷
|
2卷引用:浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题
名校
6 . 近日,南开大学化学院先进能源材料实验室发布:在缬氨酸做表面配体时制备出了一种可广泛用于电学和光学领域的新型钙钛矿型材料(CsPbBr3),该研究成果大大推进了材料化学的发展。
回答下列问题:
(1)基态Ti原子的外围电子排布式为__ ,基态Ti原子核外电子的空间运动状态有__ 种。
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)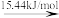 Br2(g)
Br2(g)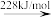 2Br(g)
2Br(g)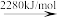 2Br+(g)
2Br+(g)
Br—Br键的键能为___ kJ/mol,Br的第一电离能为__ kJ/mol。
(3)缬氨酸的结构简式为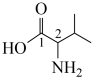 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为__ ,键角1__ 键角2(填“>”“<”或“=”)。
(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为__ 。
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为__ ,若A原子的坐标参数为(0,0,0),B原子的坐标参数为(0,0, ),则C原子的坐标参数为
),则C原子的坐标参数为__ 。
②请在图b中画出图a晶胞中所有Br-的投影位置___ 。
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为__ g•cm-3(用含a、NA的代数式表示,列出计算式即可)。
回答下列问题:
(1)基态Ti原子的外围电子排布式为
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)
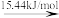 Br2(g)
Br2(g)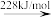 2Br(g)
2Br(g)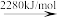 2Br+(g)
2Br+(g)Br—Br键的键能为
(3)缬氨酸的结构简式为
 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为
 ),则C原子的坐标参数为
),则C原子的坐标参数为②请在图b中画出图a晶胞中所有Br-的投影位置
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(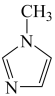 )反应可以得到
)反应可以得到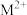 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
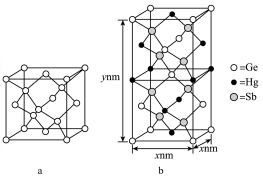
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到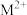 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次
2021高三·全国·专题练习
8 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2,H2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)键能是衡量共价键稳定性的参数之一、 CH3OH键参数中有___________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________ 。
(2)X的晶胞结构如图所示(晶胞参数:α=β=γ=90º,a=b=450.25 pm),密度为1.4 g cm-3,H-的配位数为___________ , X的储氢质量分数是___________ ,c=___________ pm (列出计算式即可)。

回答问题:
(1)键能是衡量共价键稳定性的参数之一、 CH3OH键参数中有
(2)X的晶胞结构如图所示(晶胞参数:α=β=γ=90º,a=b=450.25 pm),密度为1.4 g cm-3,H-的配位数为

您最近一年使用:0次
解题方法
9 . 钴(Co)是一种重要的战略金属,钴的合金及其配合物用途非常广泛。有一种钴的配合物,化学式为 。请回答下列问题:
。请回答下列问题:
(1)钴在元素周期表中的位置为_______ 。
(2)在该配合物中,钴的化合价为_______ 。
(3)该配合物中含有的化学键有_______ 。
(4)该配合物中阴离子的中心原子采取的杂化方式为_______ , 的立体构型为
的立体构型为_______ ,H2O的VSEPR模型名称为_______ 。
(5)已知 、
、 分子的键角信息如下表所示,试解释
分子的键角信息如下表所示,试解释 比
比 键角大的原因
键角大的原因_______ 。
 。请回答下列问题:
。请回答下列问题:(1)钴在元素周期表中的位置为
(2)在该配合物中,钴的化合价为
(3)该配合物中含有的化学键有
(4)该配合物中阴离子的中心原子采取的杂化方式为
 的立体构型为
的立体构型为(5)已知
 、
、 分子的键角信息如下表所示,试解释
分子的键角信息如下表所示,试解释 比
比 键角大的原因
键角大的原因| 分子 |  |  |
| 键角 | 105° | 107° |
您最近一年使用:0次
解题方法
10 . 钴常见的化合价为+2、+3,钴及其化合物在工业上具有重要的用途。请回答下列问题:
(1)钴在元素周期表中属于___________ 区元素,与钴同周期且基态原子与基态钴原子具有相同未成对电子数的元素是___________ (填元素符号)。
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是___________ (填离子符号),原因为___________ 。
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为___________ 。
②NH3中的H-N-H的键角___________ (填“大于”或“小于”)NH 中H-N-H的键角
中H-N-H的键角
③[Co(NH3)6]Cl3中存在的作用力类型有___________ (填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
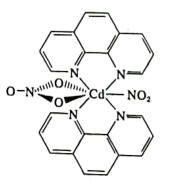
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N的杂化方式有___________ 种。
(1)钴在元素周期表中属于
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为
②NH3中的H-N-H的键角
 中H-N-H的键角
中H-N-H的键角③[Co(NH3)6]Cl3中存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次



