名校
解题方法
1 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
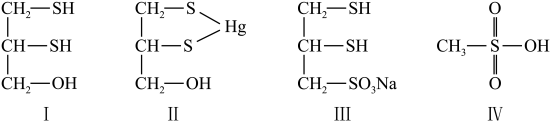
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
2 . 我国科学家在《NationalScienceReview》上报道了具有特殊稳定性的类钙钛矿结构中性团簇Co13O8,理论研究表明该团簇具有独特的立方芳香性。这类新型的氧钝化金属团簇有望用作基因新材料,研究人员将其命名为“金属氧立方”。回答下列问题:
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图_______ 。
(2)辉砷钴矿(主要成分为CoAsS)是一种常见的钴矿石。
①CoAsS中三种元素的电负性大小关系为_______ 。O、S的简单氢化物分子键角从大到小的顺序及原因是_______ 。
②砷的硫化物有多种,有一种硫化砷的结构为 ,则该分子中发生sp3杂化的元素有
,则该分子中发生sp3杂化的元素有_______ 种;还有一种线型结构As2S2,该分子中各原子均达到8电子稳定结构,As2S2的电子式为_______ 。
(3)钴离子极易形成配合物,如[Co(NH3)6](NO3)3,与NH3互为等电子体的阳离子有_______ (任写一种), 中的大π键为
中的大π键为_______ 。
(4)钴的一种化合物晶胞结构如下图所示:

①晶胞中,Co原子位于O原子构成的_______ 空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3,则晶胞中Ti与O的最近距离是_______ nm(用含ρ、NA的代数式表示)。
(1)钴元素的常见价态为+2和+3。写出+3价基态钴离子的价电子排布图
(2)辉砷钴矿(主要成分为CoAsS)是一种常见的钴矿石。
①CoAsS中三种元素的电负性大小关系为
②砷的硫化物有多种,有一种硫化砷的结构为
 ,则该分子中发生sp3杂化的元素有
,则该分子中发生sp3杂化的元素有(3)钴离子极易形成配合物,如[Co(NH3)6](NO3)3,与NH3互为等电子体的阳离子有
 中的大π键为
中的大π键为(4)钴的一种化合物晶胞结构如下图所示:

①晶胞中,Co原子位于O原子构成的
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3,则晶胞中Ti与O的最近距离是
您最近一年使用:0次
名校
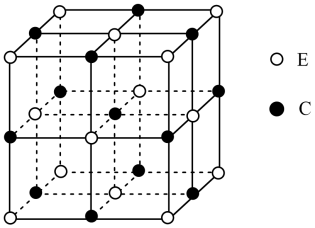
3 . 元素A、B、C、D、E、F、G在元素周期表中的位置如图所示,回答下列问题:

(1)G的基态原子核外电子排布式为____ 。原子的第一电离能:D____ E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是____ 。
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于____ 晶体,该物质中存在的化学键类型有___ 。
(4)化合物BCF2的立体构型为____ ,其中B原子的杂化轨道类型是____ 。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。列式计算EC晶体的密度(g·cm-3)____ 。

(1)G的基态原子核外电子排布式为
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l—l>l—b>b—b(l为孤对电子对,b为键合电子对),则关于A2C中的A—C—A键角可得出的结论是
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(4)化合物BCF2的立体构型为
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。列式计算EC晶体的密度(g·cm-3)

您最近一年使用:0次
名校
解题方法
4 . 2021年7月4日,“神舟十二号”航天员圆满完成出舱任务。“神舟十二号”制作材料中包含了 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1) 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ , 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为___________ 。
(2) 位于元素周期表的
位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区, 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是___________ 。
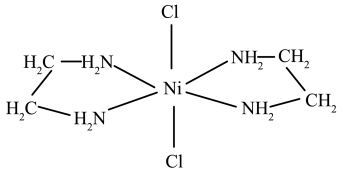
(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有___________ 个,该整合物中C的杂化方式为___________ 。
 、
、 、
、 、
、 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为 、
、 、
、 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(2)
 位于元素周期表的
位于元素周期表的 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(3)含有两个或两个以上配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。
 的一种螯合物结构如图所示,
的一种螯合物结构如图所示, 该配合物中通过鳌合作用形成的配位键有
该配合物中通过鳌合作用形成的配位键有
您最近一年使用:0次
名校
5 . 中国医学工作者曾因“硒与克山病”和“硒预防肝癌研究”的突破性科研成果而两次获得由国际生物无机化学家协会颁发的“施瓦茨奖”。请回答下列问题:
(1)基态Se原子的价电子排布图为_______ ,Se与其同周期且相邻的两种元素的第一电离能由大到小的顺序为_______ (用元素符号表示)。
(2)SeO2与水反应能生成H2SeO3,H2SeO3中Se原子的杂化轨道类型为_______ ,H2SeO3与H2SO3相比酸性较强的是_______ (填化学式)。
(3)SeO3属于_______ (填“极性”或“非极性”)分子。SeO3与SeO2相比,O-Se-O键角较大的是_______ (填化学式),原因为_______ 。
(4)一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:

①该化合物的化学式为_______ ;
②若晶胞密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中距离最近的两个Se原子的核间距为_______ pm。
(1)基态Se原子的价电子排布图为
(2)SeO2与水反应能生成H2SeO3,H2SeO3中Se原子的杂化轨道类型为
(3)SeO3属于
(4)一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:

①该化合物的化学式为
②若晶胞密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中距离最近的两个Se原子的核间距为
您最近一年使用:0次
2021-12-22更新
|
326次组卷
|
2卷引用:河北省邯郸市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
6 . 铝硅酸盐型分子筛的吸附能力高、选择性强、耐高温。广泛用于有机化工和石油化工。钙铝硅酸盐型分子筛化学纠成可表示为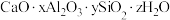 。回答下列问题:
。回答下列问题:
(1) 与
与 同主族,基态
同主族,基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ ,晶体硅和碳化硅熔点较高的是___________ (填化学式)。
(2)O元素能与卤素形成多种氧化物, 分子中
分子中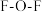 的键角
的键角___________ (填“大于”或“小于”) 分子中
分子中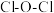 的键角,原因是
的键角,原因是___________ 。
(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成 型化学键,这种不局限在两个原子之间的
型化学键,这种不局限在两个原子之间的 键称为离域
键称为离域 键,或大
键,或大 键。下列微粒中不存在离域
键。下列微粒中不存在离域 键的是___________(填序号)
键的是___________(填序号)
(4)金属钙在空气中燃烧除有氧化物生成外,还有氮化物生成,因此在电子工业中常用钙除去体系中不必要的氧气和氮气。钙与氮气化合所得氮化钙的晶胞结构如图所示。该晶体属立方晶系, 的半径为
的半径为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 与
与 间的作用力为
间的作用力为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为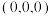 ,则B点原子的分数坐标为
,则B点原子的分数坐标为___________ 。阿伏加德罗常数的值为 ,该晶体的密度
,该晶体的密度___________  (写出表达式)。
(写出表达式)。

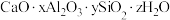 。回答下列问题:
。回答下列问题:(1)
 与
与 同主族,基态
同主族,基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)O元素能与卤素形成多种氧化物,
 分子中
分子中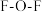 的键角
的键角 分子中
分子中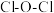 的键角,原因是
的键角,原因是(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成
 型化学键,这种不局限在两个原子之间的
型化学键,这种不局限在两个原子之间的 键称为离域
键称为离域 键,或大
键,或大 键。下列微粒中不存在离域
键。下列微粒中不存在离域 键的是___________(填序号)
键的是___________(填序号)A. | B.. (白磷分子) (白磷分子) | C. | D. |
 的半径为
的半径为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 与
与 间的作用力为
间的作用力为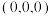 ,则B点原子的分数坐标为
,则B点原子的分数坐标为 ,该晶体的密度
,该晶体的密度 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
名校
7 . 近日,南开大学化学院先进能源材料实验室发布:在缬氨酸做表面配体时制备出了一种可广泛用于电学和光学领域的新型钙钛矿型材料(CsPbBr3),该研究成果大大推进了材料化学的发展。
回答下列问题:
(1)基态Ti原子的外围电子排布式为__ ,基态Ti原子核外电子的空间运动状态有__ 种。
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)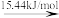 Br2(g)
Br2(g)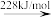 2Br(g)
2Br(g)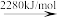 2Br+(g)
2Br+(g)
Br—Br键的键能为___ kJ/mol,Br的第一电离能为__ kJ/mol。
(3)缬氨酸的结构简式为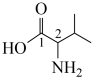 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为__ ,键角1__ 键角2(填“>”“<”或“=”)。
(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为__ 。
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为__ ,若A原子的坐标参数为(0,0,0),B原子的坐标参数为(0,0, ),则C原子的坐标参数为
),则C原子的坐标参数为__ 。
②请在图b中画出图a晶胞中所有Br-的投影位置___ 。
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为__ g•cm-3(用含a、NA的代数式表示,列出计算式即可)。
回答下列问题:
(1)基态Ti原子的外围电子排布式为
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)
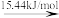 Br2(g)
Br2(g)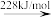 2Br(g)
2Br(g)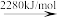 2Br+(g)
2Br+(g)Br—Br键的键能为
(3)缬氨酸的结构简式为
 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为
 ),则C原子的坐标参数为
),则C原子的坐标参数为②请在图b中画出图a晶胞中所有Br-的投影位置
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(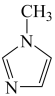 )反应可以得到
)反应可以得到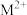 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
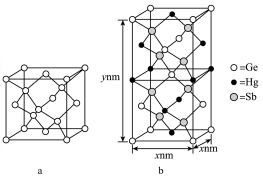
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到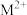 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次
2021高三·全国·专题练习
9 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2,H2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)键能是衡量共价键稳定性的参数之一、 CH3OH键参数中有___________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________ 。
(2)X的晶胞结构如图所示(晶胞参数:α=β=γ=90º,a=b=450.25 pm),密度为1.4 g cm-3,H-的配位数为___________ , X的储氢质量分数是___________ ,c=___________ pm (列出计算式即可)。

回答问题:
(1)键能是衡量共价键稳定性的参数之一、 CH3OH键参数中有
(2)X的晶胞结构如图所示(晶胞参数:α=β=γ=90º,a=b=450.25 pm),密度为1.4 g cm-3,H-的配位数为

您最近一年使用:0次
2021高三·全国·专题练习
解题方法
10 . 由浙江大学饶灿教授课题组发现的一种新矿物LiAl5O8,被国际矿物学协会命名为“竺可桢石”,英文名为Chukochenite。回答下列问题:

(1)某锂钴复合氧化物晶胞如图1所示。该化合物的化学式为___________ 。Co3+和NH3形成配离子[Co(NH3)6]3+,游离态NH3中键角∠HNH___________ (填“大于”“小于”或“等于”)[Co(NH3)6]3+中键角∠HNH。
(2)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属于正交晶系(长方体形)。晶胞参数为0.75nm、1.0nm、0.56nm。如图2为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
①据此推断该晶胞中氯原子数目为___________ 。LiCl·3H2O的摩尔质量为Mg·mol-1,晶胞密度为dg·cm-3,则阿伏加德罗常数NA为___________ mol-1(列出计算表达式)。
②图2中A、B两原子核间距离为___________ nm(只列计算式)。

(1)某锂钴复合氧化物晶胞如图1所示。该化合物的化学式为
(2)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属于正交晶系(长方体形)。晶胞参数为0.75nm、1.0nm、0.56nm。如图2为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
①据此推断该晶胞中氯原子数目为
②图2中A、B两原子核间距离为
您最近一年使用:0次



