名校
解题方法
1 . 据《科技日报》报道,我国科学家研制出一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为___________ 。
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是___________ (填元素符号)。
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为___________ 。
(4)石墨烯限域单原子铁能活化 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力___________ (填“增强”或“减弱”)。
(5)常温下,在催化剂作用下, 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。
①它们的沸点由高到低的顺序为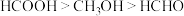 ,主要原因是
,主要原因是___________ 。
② 和
和 相比,键角较大的是
相比,键角较大的是___________ ,主要原因是___________ 。
 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为
(4)石墨烯限域单原子铁能活化
 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力(5)常温下,在催化剂作用下,
 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。①它们的沸点由高到低的顺序为
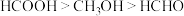 ,主要原因是
,主要原因是②
 和
和 相比,键角较大的是
相比,键角较大的是
您最近一年使用:0次
2021-02-16更新
|
450次组卷
|
4卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 章末综合检测卷
2 . Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于 区,最外层没有单电子,其余的均为短周期主族元素;
区,最外层没有单电子,其余的均为短周期主族元素;
②基态Y原子的价电子排布式为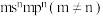 ;
;
③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的 能级有1个单电子。
能级有1个单电子。
请回答下列问题:
(1)Z在周期表中的位置为______ 。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为______ (用对应元素的符号填写)。
(3)分析下表中两种物质的键能数据(单位: )。
)。
结合数据说明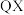 比
比 活泼的原因:
活泼的原因:__________________ 。
①Z位于
 区,最外层没有单电子,其余的均为短周期主族元素;
区,最外层没有单电子,其余的均为短周期主族元素;②基态Y原子的价电子排布式为
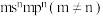 ;
;③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的
 能级有1个单电子。
能级有1个单电子。请回答下列问题:
(1)Z在周期表中的位置为
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为
(3)分析下表中两种物质的键能数据(单位:
 )。
)。 |  |  | |
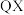 | 351 | 745 | 1076 |
 | 196 | 418 | 945 |
 比
比 活泼的原因:
活泼的原因:
您最近一年使用:0次
解题方法
3 . 磷化硼是一种典型的超硬无机材料,常以 、
、 为原料制备。回答下列问题:
为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___________ 。
(2)与 分子互为等电子体的一种离子为
分子互为等电子体的一种离子为___________ (填化学式)。
(3) 分子的空间结构为
分子的空间结构为___________ ; 的沸点
的沸点___________ (填“高于”或“低于”) ,理由是
,理由是___________ 。
(4) 、
、 和
和 三种分子中键角由大到小的顺序为
三种分子中键角由大到小的顺序为___________ 。
(5) 可转化为硼酸,硼酸为一元弱酸的原因是
可转化为硼酸,硼酸为一元弱酸的原因是______ (用离子方程式表示)。
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)_______

 、
、 为原料制备。回答下列问题:
为原料制备。回答下列问题:(1)基态P原子与B原子中未成对电子数之比为
(2)与
 分子互为等电子体的一种离子为
分子互为等电子体的一种离子为(3)
 分子的空间结构为
分子的空间结构为 的沸点
的沸点 ,理由是
,理由是(4)
 、
、 和
和 三种分子中键角由大到小的顺序为
三种分子中键角由大到小的顺序为(5)
 可转化为硼酸,硼酸为一元弱酸的原因是
可转化为硼酸,硼酸为一元弱酸的原因是(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)

您最近一年使用:0次
解题方法
4 . 铝是地壳中含量最高的金属,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)AlCl3易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:
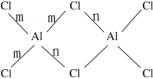
①基态氯原子价电子轨道表示式为_______ 。
②从键的形成角度分析m键和n键的区别_______ 。
(2)LiAlH4是一种强还原剂,能将乙酸(结构如下图所示)直接还原成乙醇。CH3COOH CH3CH2OH
CH3CH2OH
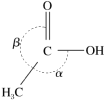
①AlH 的空间构型是
的空间构型是________ 。
②CH3COOH分子中键角α______ β(填“>”、“=”或“<”),原因是________ 。
(3)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:
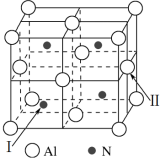
①晶胞中Al的配位数是___________ ,若该晶胞的参数为a pm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值)
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,如晶胞中I的分数坐标为( ,
, ,
, ),试写出晶胞中II的分数坐标
),试写出晶胞中II的分数坐标___________ 。
(1)AlCl3易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①基态氯原子价电子轨道表示式为
②从键的形成角度分析m键和n键的区别
(2)LiAlH4是一种强还原剂,能将乙酸(结构如下图所示)直接还原成乙醇。CH3COOH
 CH3CH2OH
CH3CH2OH
①AlH
 的空间构型是
的空间构型是②CH3COOH分子中键角α
(3)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:


①晶胞中Al的配位数是
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,如晶胞中I的分数坐标为(
 ,
, ,
, ),试写出晶胞中II的分数坐标
),试写出晶胞中II的分数坐标
您最近一年使用:0次
解题方法
5 . 石墨因其自身和石墨烯在多方应用上的突出表现,而再次成为化学科学研究的热门。
(1)石墨晶体是层状结构(如图甲),在层与层之间,靠___________ 结合;在层内,每一个碳原子都跟其他3个碳原子结合,图乙是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子总数是___________ 个。图丙是石墨晶体的晶胞图,一个这样的晶胞占有___________ 个碳原子。 图丁是金刚石晶体 (一部分)的结构示意图,石墨晶体与金刚石晶体对比,碳原子的杂化方式前者是___________ 杂化,后者是___________ 杂化。

(2)石墨烯是一种由单层碳原子构成的平面结构新型导电材料,靠层上各个碳原子(如下图甲中的1号碳原子) 2p上的一个___________ (填 “已参与杂化”或“未参与杂化”)的电子形成大π共轭体系,石墨烯中碳碳键的键能要比金刚石中碳碳键的键能___________ (填“强”或“弱”)。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如下图乙),氧化石墨烯中键角
___________ (填“>”“<”或“=”)键角β,原因是___________ 。
(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子围成的正六边形中(如下图丙)。此石墨间隙化合物可用化学式CxK表示,其中x=___________ 。

(4)石墨烯可转化为富勒烯(C60),图甲是富勒烯的结构示意图,一个C60中有___________ 根共价键,富勒烯的熔点比石墨___________ (填“高”或“低”)。富勒烯也能与K形成新型化合物,其晶胞如图乙所示,晶胞棱长为a nm,该晶体的密度(用含a的代数式表示)_____ g/cm-3

(1)石墨晶体是层状结构(如图甲),在层与层之间,靠

(2)石墨烯是一种由单层碳原子构成的平面结构新型导电材料,靠层上各个碳原子(如下图甲中的1号碳原子) 2p上的一个

(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子围成的正六边形中(如下图丙)。此石墨间隙化合物可用化学式CxK表示,其中x=

(4)石墨烯可转化为富勒烯(C60),图甲是富勒烯的结构示意图,一个C60中有

您最近一年使用:0次
解题方法
6 . D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物形成的分子的键角是__________ 度;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是___________ ,写出该元素的任意2种含氧酸的化学式:___________________________________ ;
(3)D的氢化物与X的氢化物沸点比较,沸点高的是________ (填化学式),原因是_________________________
(4)D 分别与Y、Z形成的化合物中D采用的杂化方式为_______ 、 _________ .
(5)E的氢化物与Z的氢化物反应后生成的物质存在的化学键有_______
A: 离子键 B:极性共价键 C:非极性共价键 D:配位键
(1)Y的最高价氧化物形成的分子的键角是
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
(3)D的氢化物与X的氢化物沸点比较,沸点高的是
(4)D 分别与Y、Z形成的化合物中D采用的杂化方式为
(5)E的氢化物与Z的氢化物反应后生成的物质存在的化学键有
A: 离子键 B:极性共价键 C:非极性共价键 D:配位键
您最近一年使用:0次
2020-11-01更新
|
101次组卷
|
2卷引用:辽宁省盘锦市第二高级中学2020-2021学年高二下学期第一阶段考试化学试题
7 . (1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___ (填元素符号)。
②CH3COOH中C原子轨道杂化类型为___ ;1 mol CH3COOH分子含有σ键的数目为___ 。
(2)CS2分子中,C原子的杂化轨道类型是____ ,写出两个与CS2具有相同空间构型和键合形式的离子____ 。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
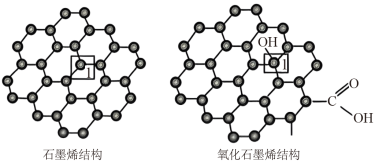
氧化石墨烯中,1号C的杂化方式是____ ,该C与相邻C形成的C-C键角____ (填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是
②CH3COOH中C原子轨道杂化类型为
(2)CS2分子中,C原子的杂化轨道类型是
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。

氧化石墨烯中,1号C的杂化方式是
您最近一年使用:0次
2019-04-21更新
|
99次组卷
|
2卷引用:(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷
解题方法
8 . 钒(23V)是我国的丰产元素,广泛应用于催化及钢铁工业,有“化学面包”、金属“维生素”之称。回答下列问题:
(1)钒原子的核外电子排布式为________________ ,在元素周期表中的位置为______ 。
(2)V2O5常用作SO2转化为SO3的催化剂。基态S原子电子占据最高能级的电子云轮廓为________ 形;气态SO3以单分子形式存在,其分子的立体构型为_______ 形;固体SO3的三聚体环状结构如图所示,该结构中S—O键长有a、b两类,b的键长大于a的键长的原因为______________ 。
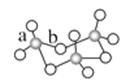
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子中V的杂化轨道类型为___________ ;也可得到偏钒酸钠,其阴离子呈如图所示的无限链状结构,则偏钒酸钠的化学式为_____________ 。
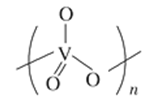
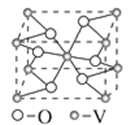
(4)钒的某种氧化物晶胞结构如图所示。该氧化物的化学式为__________ ,若它的晶胞参数为x nm,则晶胞的密度为__________ g/cm3。
(1)钒原子的核外电子排布式为
(2)V2O5常用作SO2转化为SO3的催化剂。基态S原子电子占据最高能级的电子云轮廓为

(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子中V的杂化轨道类型为

(4)钒的某种氧化物晶胞结构如图所示。该氧化物的化学式为

您最近一年使用:0次
2019-01-30更新
|
272次组卷
|
2卷引用:河北省元氏县第四中学2020-2021学年高二上学期期末考试化学试题



