名校
解题方法
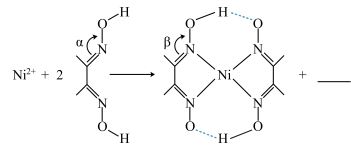
1 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(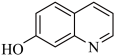 )、6−羟基喹啉(
)、6−羟基喹啉(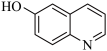 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
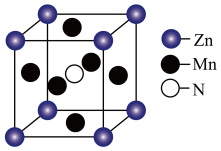
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
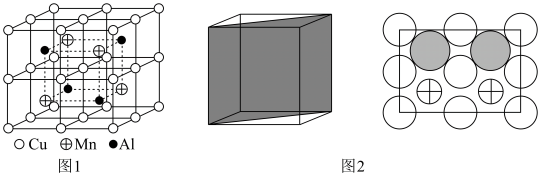
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
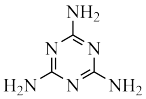
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.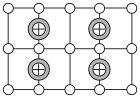 | B.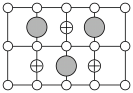 |
C. | D.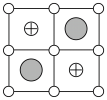 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
解题方法
2 . 钛酸钡粉体是电子陶瓷元器件的母体材料,广泛应用于多个领域。以BaCl2溶液、TiCl4溶液、H2C2O4溶液为原料制备前驱体草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再经高温煅烧制得钛酸钡粉体。
(1)Ti位于元素周期表中的___________ 区。
(2)补全制备前驱体草酸氧钛钡晶体的化学反应方程式。___________ 。
BaCl2+TiCl4+2H2C2O4+H2O=BaTiO(C2O4)2·4H2O↓+___________
(3)煅烧过程中有无水草酸氧钛钡晶体生成,其结构如图所示。
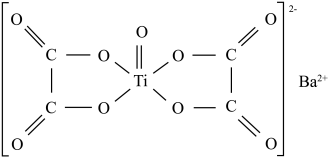
① 中的C原子采取
中的C原子采取___________ 杂化轨道成键。
②理论研究表明: 中四个碳氧键完全相同,
中四个碳氧键完全相同, 所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是___________ 。

③H2C2O4的Ka1大于CH3COOH的Ka,从结构角度解释原因___________ 。
(4)立方钛酸钡晶体的结构如图所示。
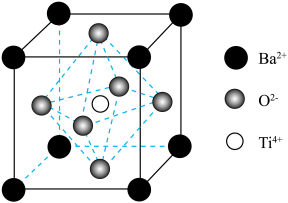
①O2-周围与它最近且距离相等的O2-有___________ 个。
②该晶体晶胞的边长为anm,晶体密度为___________ g·cm-3。(列出计算式,已知阿伏伽德罗常数为NA,1nm=10-7cm)
(1)Ti位于元素周期表中的
(2)补全制备前驱体草酸氧钛钡晶体的化学反应方程式。
BaCl2+TiCl4+2H2C2O4+H2O=BaTiO(C2O4)2·4H2O↓+___________
(3)煅烧过程中有无水草酸氧钛钡晶体生成,其结构如图所示。

①
 中的C原子采取
中的C原子采取②理论研究表明:
 中四个碳氧键完全相同,
中四个碳氧键完全相同, 所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
③H2C2O4的Ka1大于CH3COOH的Ka,从结构角度解释原因
(4)立方钛酸钡晶体的结构如图所示。

①O2-周围与它最近且距离相等的O2-有
②该晶体晶胞的边长为anm,晶体密度为
您最近一年使用:0次
3 . 绿矾 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
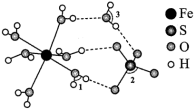
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的_______ 区。
(2)基态S原子核外电子空间运动状态有___________ 种,电子占据最高能级的电子云轮廓图形状为___________ 。
(3) 中
中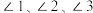 由大到小的顺序是
由大到小的顺序是___________ 。
(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:___________ 。
 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的
(2)基态S原子核外电子空间运动状态有
(3)
 中
中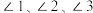 由大到小的顺序是
由大到小的顺序是(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:
您最近一年使用:0次
4 . 过渡元素锰能形成很多重要的化合物。回答下列问题:
(1)三醋酸锰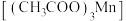 是一种有机反应氧化剂。Mn在元素周期表中的位置为
是一种有机反应氧化剂。Mn在元素周期表中的位置为___________ 。下列表示锰原子处于激发态的有___________ (填标号,下同),其中能量较高的是___________ 。
a.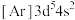 b.
b.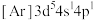 c.
c.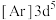 d.
d.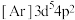
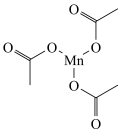
(2)三醋酸锰是一种配合物,其结构如图所示,所含 键和
键和 键个数之比为
键个数之比为___________ 。羧酸可表示为A―H, 、
、 和
和 酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是___________ 。
(3)锰酸锂( )可作为锂离子电池的正极材料,通过
)可作为锂离子电池的正极材料,通过 嵌入或脱嵌实现充放电。
嵌入或脱嵌实现充放电。
①锰酸锂可充电电池的总反应为: 。
。 从锰酸锂中脱嵌的过程为
从锰酸锂中脱嵌的过程为___________ 。(填“放电”或“充电”)过程,对应的电极反应式为___________ 。
② 晶胞可看成由图1中A、B单元按图2方式构成。图1中“
晶胞可看成由图1中A、B单元按图2方式构成。图1中“ ”表示
”表示 ,则“
,则“ ”表示的微粒是
”表示的微粒是___________ 。(填离子符号)。

(1)三醋酸锰
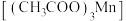 是一种有机反应氧化剂。Mn在元素周期表中的位置为
是一种有机反应氧化剂。Mn在元素周期表中的位置为a.
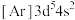 b.
b.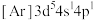 c.
c.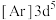 d.
d.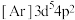
(2)三醋酸锰是一种配合物,其结构如图所示,所含
 键和
键和 键个数之比为
键个数之比为 、
、 和
和 酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
(3)锰酸锂(
 )可作为锂离子电池的正极材料,通过
)可作为锂离子电池的正极材料,通过 嵌入或脱嵌实现充放电。
嵌入或脱嵌实现充放电。①锰酸锂可充电电池的总反应为:
 。
。 从锰酸锂中脱嵌的过程为
从锰酸锂中脱嵌的过程为②
 晶胞可看成由图1中A、B单元按图2方式构成。图1中“
晶胞可看成由图1中A、B单元按图2方式构成。图1中“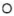 ”表示
”表示 ,则“
,则“ ”表示的微粒是
”表示的微粒是
您最近一年使用:0次
解题方法
5 . 请回答下列问题:
(1)由磷原子核形成的三种微粒:a.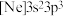 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为___________ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)比较H-O-H键角大小;H3O+___________ H2O(填“>”、“<”或“=”)。
(3)胍(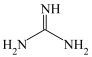 )分子中所有原子共平面,胍中N杂化方式为
)分子中所有原子共平面,胍中N杂化方式为___________ 。
(4)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,下图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用•表示),试在小立方体画出相应C原子(用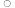 表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。
表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。___________

(1)由磷原子核形成的三种微粒:a.
 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为(2)比较H-O-H键角大小;H3O+
(3)胍(
 )分子中所有原子共平面,胍中N杂化方式为
)分子中所有原子共平面,胍中N杂化方式为(4)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,下图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用•表示),试在小立方体画出相应C原子(用
 表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。
表示)的位置,在大正方体画出相应Si原子(用•表示)的位置。
您最近一年使用:0次
2024-03-04更新
|
250次组卷
|
2卷引用:浙江省杭州学军中学海创园学校2023-2024学年高二上学期期末考试化学试题
名校
6 . M、N、R、X、Y五种元素在元素周期表中的位置如下图所示。元素M和R的原子序数之和等于N的原子序数,元素R和X的原子序数之和等于Y的原子序数。
(1)N的元素名称为_______ 。
(2)在同周期元素中,比元素M的第一电离能小的元素有______ 种。
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为_______ 。
②比较MX3、MY3键角大小∠XMX_____ ∠YMY(填“>”、“<”或“=”)
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)____ pKa(CH3COOH)(填“>”、“<”或“=”)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有_____ 种。
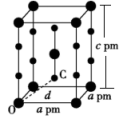
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=___ pm。
| M | R | X |
| N | Y |
(2)在同周期元素中,比元素M的第一电离能小的元素有
(3)元素M与元素X、Y形可成化合物MX3、MY3,MY3分子中元素Y的化合价为+1价。
①化合物MX3分子构型为
②比较MX3、MY3键角大小∠XMX
(4)基团的诱导效应对有机酸的酸性有较大的影响。有机酸的酸性强弱可用电离常数的负对数pKa的大小来衡量,则pKa(CH2XCOOH)
(5)元素X的简单氢化物HX极易溶于水,其重要原因是HX分子可以跟水分子形成氢键,那么在HX的水溶液中可能存在的氢键类型有
(6)化合物XeX2的晶体属四方晶系,晶胞参数如图所示(晶胞棱边夹角均为90°)。已知Xe-X键长为rpm,晶胞中O、C间距离d=

您最近一年使用:0次
名校
解题方法
7 . 硅、锗(Ge)、镓及其化合物广泛应用于光电材料领域。请回答:
(1)比较硅与锗的第一电离能大小:Si___________ (填“>”或“<”)Ge。
(2)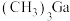 分子是
分子是___________ (填“极性”或“非极性”)分子。
(3)氮化硅( )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且最外层均达到8电子稳定结构,比较晶体结构中键角大小:
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且最外层均达到8电子稳定结构,比较晶体结构中键角大小:
___________ (填“>”“<”“=”) 。
。

(4)GaAs的熔点为1238℃,其晶胞结构如图所示,该晶体中Ga和As以___________ 键结合,Ga的配位数为________ 。若GaAs晶胞边长为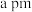 ,则Ga与最近As的核间距为
,则Ga与最近As的核间距为_________ pm。

(1)比较硅与锗的第一电离能大小:Si
(2)
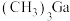 分子是
分子是(3)氮化硅(
 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且最外层均达到8电子稳定结构,比较晶体结构中键角大小:
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且最外层均达到8电子稳定结构,比较晶体结构中键角大小:
 。
。
(4)GaAs的熔点为1238℃,其晶胞结构如图所示,该晶体中Ga和As以
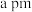 ,则Ga与最近As的核间距为
,则Ga与最近As的核间距为
您最近一年使用:0次
名校
8 . 2020年11月24日4时30分,长征五号遥五运载火箭在中国文昌航天发射场点火升空,将嫦娥五号月球探测器运送至地月转移轨道,开启我国首次地外天体采样返回之旅。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素等。
(1)钛在元素周期表中的位置是___________ ,与Ti处于同周期、未成对电子数与Ti相同的元素还有___________ 种。
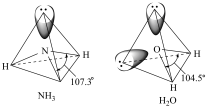
(2)[Cu(NH3)4]SO4·H2O是一种蓝色晶体,其中的NH3、H2O的空间结构和相应的键角如图所示,H2O的键角比NH3小的原因是___________ 。
(3)基态铁原子的价层电子排布图为___________ 。相同条件下,Fe3+和Fe2+相比,___________ 更稳定,原因是___________ 。
(4)某钙钛矿的晶体结构属于立方结构,具有高度的对称性,其晶胞结构如图所示。
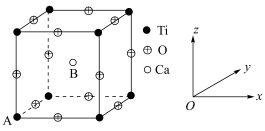
①在该晶体中每个钛离子周围与它最近且距离相等的钛离子有___________ 个。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A的原子分数坐标为(0,0,0),则B(Ca)的原子分数坐标为___________ 。
(1)钛在元素周期表中的位置是
(2)[Cu(NH3)4]SO4·H2O是一种蓝色晶体,其中的NH3、H2O的空间结构和相应的键角如图所示,H2O的键角比NH3小的原因是

(3)基态铁原子的价层电子排布图为
(4)某钙钛矿的晶体结构属于立方结构,具有高度的对称性,其晶胞结构如图所示。

①在该晶体中每个钛离子周围与它最近且距离相等的钛离子有
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A的原子分数坐标为(0,0,0),则B(Ca)的原子分数坐标为
您最近一年使用:0次
名校
解题方法
9 . 开发高效储氢材料是重要的研究方向。回答下列问题:
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态 原子的电子排布式为
原子的电子排布式为___________ 。
②石墨烯中碳碳键长___________ 乙烯中碳碳键长(填“>”“<”或“=”。)
③下列反应常用来检验,请补全方程式:_______ 
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)镧(La)和氢原子可以形成一系列储氢晶体材料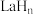 ,
,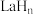 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有___________ 种,晶胞中La原子个数与正四面体空隙数之比为___________ ,H原子的配位数为___________ 。
②高压下, 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为___________ (x用数字表示)。若 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为___________ pm(用含a和b的式子表示)。
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态
 原子的电子排布式为
原子的电子排布式为②石墨烯中碳碳键长
③下列反应常用来检验,请补全方程式:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)镧(La)和氢原子可以形成一系列储氢晶体材料
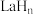 ,
,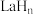 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。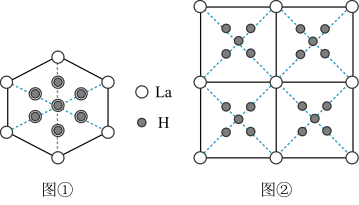
 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有②高压下,
 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为
您最近一年使用:0次
2024-02-06更新
|
574次组卷
|
2卷引用:山东省威海市2023-2024学年高三上学期期末考试化学试题
名校
解题方法
10 . 碳和硫的化合物种类繁多,应用广泛。例如CS2是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有___________ 种。基态碳原子的价电子排布是否可以表示为 ,
,___________ (填“是”或“否”),原因为___________ 。
(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有___________ (填标号)。
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角___________ (填“大于”、“小于”或“等于”)甲醛分子中H-C-H的键角,原因为___________ 。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根( )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。硫代硫酸盐用于矿石提取银时形成 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为___________ (填标号),原因为___________ 。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=___________ 。原子b的分数坐标为(0,0,0),则原子a的分数坐标为___________ 。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有
 ,
,(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根(
 )中心原子的杂化方式为
)中心原子的杂化方式为 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=

您最近一年使用:0次
2024-02-02更新
|
467次组卷
|
4卷引用:山东省青岛市黄岛区2023-2024学年高三上学期期末考试化学试题



