过渡元素锰能形成很多重要的化合物。回答下列问题:
(1)三醋酸锰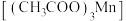 是一种有机反应氧化剂。Mn在元素周期表中的位置为
是一种有机反应氧化剂。Mn在元素周期表中的位置为___________ 。下列表示锰原子处于激发态的有___________ (填标号,下同),其中能量较高的是___________ 。
a.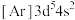 b.
b.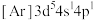 c.
c.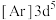 d.
d.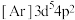
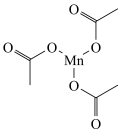
(2)三醋酸锰是一种配合物,其结构如图所示,所含 键和
键和 键个数之比为
键个数之比为___________ 。羧酸可表示为A―H, 、
、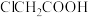 和
和 酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是___________ 。
(3)锰酸锂( )可作为锂离子电池的正极材料,通过
)可作为锂离子电池的正极材料,通过 嵌入或脱嵌实现充放电。
嵌入或脱嵌实现充放电。
①锰酸锂可充电电池的总反应为: 。
。 从锰酸锂中脱嵌的过程为
从锰酸锂中脱嵌的过程为___________ 。(填“放电”或“充电”)过程,对应的电极反应式为___________ 。
② 晶胞可看成由图1中A、B单元按图2方式构成。图1中“
晶胞可看成由图1中A、B单元按图2方式构成。图1中“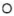 ”表示
”表示 ,则“
,则“ ”表示的微粒是
”表示的微粒是___________ 。(填离子符号)。

(1)三醋酸锰
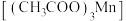 是一种有机反应氧化剂。Mn在元素周期表中的位置为
是一种有机反应氧化剂。Mn在元素周期表中的位置为a.
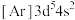 b.
b.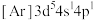 c.
c.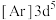 d.
d.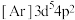
(2)三醋酸锰是一种配合物,其结构如图所示,所含
 键和
键和 键个数之比为
键个数之比为 、
、 和
和 酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
酸性随A―H间的电子云密度增大而减弱,其中酸性最弱的是
(3)锰酸锂(
 )可作为锂离子电池的正极材料,通过
)可作为锂离子电池的正极材料,通过 嵌入或脱嵌实现充放电。
嵌入或脱嵌实现充放电。①锰酸锂可充电电池的总反应为:
 。
。 从锰酸锂中脱嵌的过程为
从锰酸锂中脱嵌的过程为②
 晶胞可看成由图1中A、B单元按图2方式构成。图1中“
晶胞可看成由图1中A、B单元按图2方式构成。图1中“ ”表示
”表示 ,则“
,则“ ”表示的微粒是
”表示的微粒是
更新时间:2024-03-05 11:03:52
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CO2是温室气体,CO2的利用是解决温室效应的有效途径。试回答下列问题:
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g) CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1
反应II CO2(g) + H2(g) CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
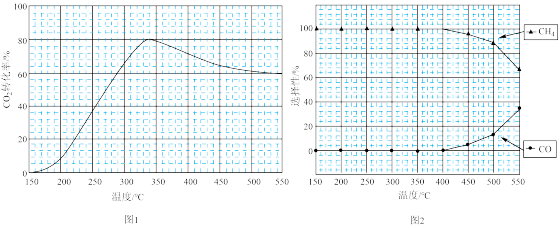
(1)①下列说法不正确的是___________
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为___________ (用a、V表示)。
II.CO2电化学制CH4
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为___________ ,电解一段时间后,阳极区KOH溶液的质量分数减小,其原因是___________ 。
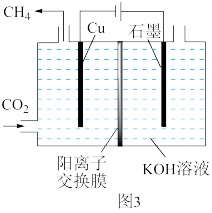
(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。
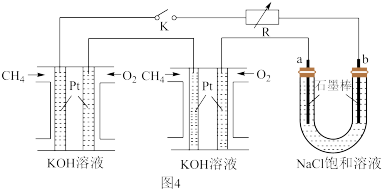
①通入甲烷气体的电极是原电池的___________ 极,其电极反应式为___________ 。
②a电极反应式为___________ 。
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为___________ (单个电子的电荷量e=1.6×10-19 C,结果保留三位有效数字),若产生的气体全部逸出,电解后溶液混合均匀,温度恢复为室温,则电解后U形管中溶液的pH为___________ 。
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。已知25℃时, 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=___________ 。
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g)
 CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1反应II CO2(g) + H2(g)
 CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
(1)①下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为
II.CO2电化学制CH4
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为

(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。

①通入甲烷气体的电极是原电池的
②a电极反应式为
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】分析如图所示装置,完成下列各题。
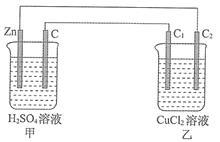
(1)一段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,石墨棒上有____________ 产生。与Zn棒相连的石墨棒质量____________ (填“增大”“减小”或“不变”)。
(2)甲池Zn极为____________ 极,电极反应式:____________________________________ 。
乙池中C1为____________ 极,电极反应式:____________________________________ 。乙池总反应式:____________________________________ 。

(1)一段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,石墨棒上有
(2)甲池Zn极为
乙池中C1为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)如图是一个化学过程的示意图。
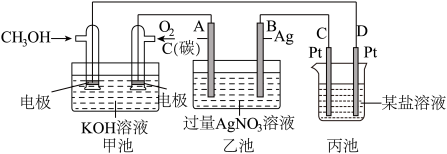
①乙池中总反应的离子方程式____________ 。
②电解一段时间后,向乙池的溶液中加入________________ 可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________ 。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
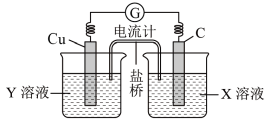
①写出负极的电极反应式:___________ 。
②图中X溶液是________ 。
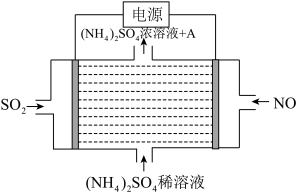
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________ ,阴极的电极反应式为______________ 。

①乙池中总反应的离子方程式
②电解一段时间后,向乙池的溶液中加入
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:
②图中X溶液是
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半;C、D同主族,且D的原子序数是C的2倍;E是第四周期ds区不活泼金属元素。根据以下信息相应的元素符号填空:
(1)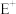 核外电子排布式为
核外电子排布式为____________ 。
(2)ABC三元素第一电离能大小顺序为________ 。
(3)D元素在周期表中的位置_________ ,能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是__________ (填化学式)。
(4)已知 溶液中滴入氨基乙酸钠
溶液中滴入氨基乙酸钠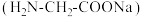 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:
配合物G: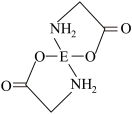
配合物G中碳原子的轨道杂化类型为____________________ 。
(5) 的电子式为
的电子式为_______________ 。
(1)
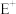 核外电子排布式为
核外电子排布式为(2)ABC三元素第一电离能大小顺序为
(3)D元素在周期表中的位置
(4)已知
 溶液中滴入氨基乙酸钠
溶液中滴入氨基乙酸钠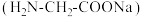 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:配合物G:

配合物G中碳原子的轨道杂化类型为
(5)
 的电子式为
的电子式为
您最近一年使用:0次
【推荐2】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ns1;B元素的原子价层电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
(1)写出元素名称:C___________ 、D___________ 、E___________ 。
(2)C基态原子的轨道表示式为___________ 。
(3)当n=2时,B的最简单气态氢化物的电子式为_________ ,BC2分子的结构式是________ ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是________ 。
(4)若A元素的原子最外层电子排布式为2s1,B元素的原子价层电子排布式为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(5)E元素原子的价层电子排布式是_______ ,其最高价氧化物的化学式是________ 。
(1)写出元素名称:C
(2)C基态原子的轨道表示式为
(3)当n=2时,B的最简单气态氢化物的电子式为
(4)若A元素的原子最外层电子排布式为2s1,B元素的原子价层电子排布式为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是
(5)E元素原子的价层电子排布式是
您最近一年使用:0次
【推荐3】过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2 的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
(1)Na 原子的核外电子排布式为_____ ,O 原子核外 L 层上有_______ 种能量不同的电子,H2O2 的电子式是_____________________________________________
(2)设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论)_____ ;并用原子结构知识对作出的结论进行解释_____ 。
(3)用一个离子方程式表示过碳酸钠溶液显碱性的原因________________________ 。
(4)高锰酸根离子( )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
_____ +_______CO
+_______CO +___H2O2→___MnCO3+___□+____OH-+____H2O
+___H2O2→___MnCO3+___□+____OH-+____H2O
补全并配平上述化学反应过程式_____ ;反应中,过碳酸钠起沉淀剂和_________ 剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1,则转移电子数为_____ mol(保留 2 位小数)
(1)Na 原子的核外电子排布式为
(2)设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论)
(3)用一个离子方程式表示过碳酸钠溶液显碱性的原因
(4)高锰酸根离子(
 )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:_____
 +_______CO
+_______CO +___H2O2→___MnCO3+___□+____OH-+____H2O
+___H2O2→___MnCO3+___□+____OH-+____H2O补全并配平上述化学反应过程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知SiH4中硅元素为+4价,则H、C、O、Si的电负性由大到小的顺序为_______ 。
(2)基态锗原子(Ge)的简化电子排布式为_______ 。
(3)氮化硅(Si3N4)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N-Si-N_______ Si-N-Si(填“>”、“<”或“=”)。

(4)基态硅原子核外电子的空间运动状态有_______ 种,太阳能电池板主要材料为单晶硅或多晶硅,硅与氢能形成一系列二元化合物如SiH4、Si2H6等,丁硅烯(Si4H8)中σ键与π键的个数比为_______ ,其中硅的杂化方式是_______ 。
(1)已知SiH4中硅元素为+4价,则H、C、O、Si的电负性由大到小的顺序为
(2)基态锗原子(Ge)的简化电子排布式为
(3)氮化硅(Si3N4)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N-Si-N

(4)基态硅原子核外电子的空间运动状态有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硒-钴-镧(La)三元整流剂在导电玻璃中应用广泛。回答下列问题:
(1)元素硒的两种微粒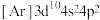 电离1个电子所需最低能量
电离1个电子所需最低能量___________ (填“>”“<”或“=”,下同)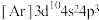 ,
, 的键角
的键角___________  的键角;硒的两种酸的酸性强弱为
的键角;硒的两种酸的酸性强弱为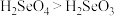 ,原因是
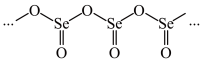
,原因是___________ ;硒的某种氧化物为如图所示的链状聚合结构,该氧化物的化学式为___________ 。
(2)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。
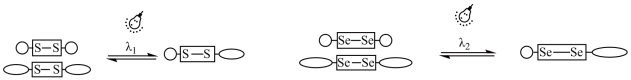
已知光的波长与键能成反比,则图中实现光响应的波长: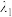
___________  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是___________ 。
(3)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为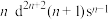 ,则Q为
,则Q为___________ (填元素符号)。该合金的晶胞结构和z轴方向的投影如图。
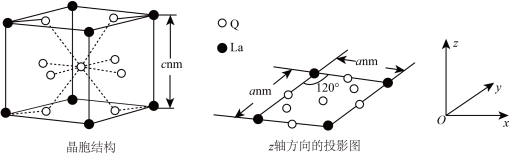
若阿伏加德罗常数的值为 ,则该合金的密度
,则该合金的密度
___________  (Q的相对原子质量用M表示,用含a、c、
(Q的相对原子质量用M表示,用含a、c、 、M的代数式表示,列出计算式即可)。
、M的代数式表示,列出计算式即可)。
(1)元素硒的两种微粒
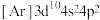 电离1个电子所需最低能量
电离1个电子所需最低能量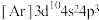 ,
, 的键角
的键角 的键角;硒的两种酸的酸性强弱为
的键角;硒的两种酸的酸性强弱为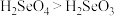 ,原因是
,原因是
(2)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(3)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为
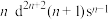 ,则Q为
,则Q为
若阿伏加德罗常数的值为
 ,则该合金的密度
,则该合金的密度
 (Q的相对原子质量用M表示,用含a、c、
(Q的相对原子质量用M表示,用含a、c、 、M的代数式表示,列出计算式即可)。
、M的代数式表示,列出计算式即可)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】GaN材料的研究与应用是目前全球半导体研究的前沿和热点,是研制微电子器件、光电子器件的新型半导体材料,GaN属于第三代半导体材料。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为_______ 。
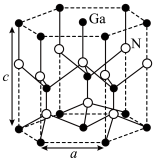
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为_______ 个。
Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
(3)有机镓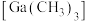 的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(
的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(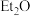 )溶剂的容器内加入镓镁(
)溶剂的容器内加入镓镁(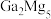 )合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到
)合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到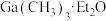 的配合物。将配合物加入高沸点有机胺
的配合物。将配合物加入高沸点有机胺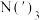 中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度
中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度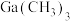 。
。
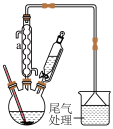
①反应仪器a的名称为____ 。三颈烧瓶中除生成 外,还有
外,还有 和
和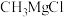 生成,该反应的化学方程式为
生成,该反应的化学方程式为______ 。
②工业上不采用直接分解 ,而采用先将
,而采用先将 加入高沸点有机胺
加入高沸点有机胺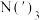 ,中,再在真空条件下分解
,中,再在真空条件下分解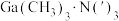 的原因为
的原因为_______ 。
已知相关物质的沸点信息如下表:
Ⅱ.MOCVD生产GaN的示意图如下:
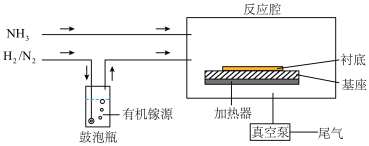
(4)采用多孔球泡的原因是_______ ,制取GaN的化学反应方程式为_______ 。
(5)工业上采用真空泵抽取尾气的原因为_______ 。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为

Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
(3)有机镓
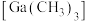 的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(
的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(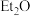 )溶剂的容器内加入镓镁(
)溶剂的容器内加入镓镁(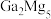 )合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到
)合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到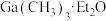 的配合物。将配合物加入高沸点有机胺
的配合物。将配合物加入高沸点有机胺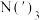 中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度
中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度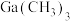 。
。
①反应仪器a的名称为
 外,还有
外,还有 和
和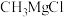 生成,该反应的化学方程式为
生成,该反应的化学方程式为②工业上不采用直接分解
 ,而采用先将
,而采用先将 加入高沸点有机胺
加入高沸点有机胺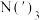 ,中,再在真空条件下分解
,中,再在真空条件下分解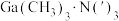 的原因为
的原因为已知相关物质的沸点信息如下表:
| 物质 | 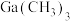 | 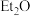 | 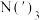 |
| 沸点/℃ | 55.8 | 34.5 | 365.8 |
Ⅱ.MOCVD生产GaN的示意图如下:

(4)采用多孔球泡的原因是
(5)工业上采用真空泵抽取尾气的原因为
您最近一年使用:0次
【推荐1】(1)气态三氧化硫以单分子形式存在,其分子的立体构型为________ 形,从电子云重叠方式看共价键的类型有________ 种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________ 。
(2)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__ 。
图1 FexNy晶胞结构示意图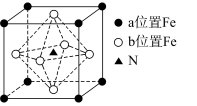 图2转化过程的能量变化
图2转化过程的能量变化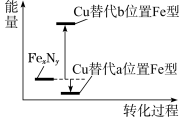
(3)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为__ nm,与K紧邻的O个数为____ 。
(4)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于_______ 位置,O处于______ 位置。
(2)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
图1 FexNy晶胞结构示意图
 图2转化过程的能量变化
图2转化过程的能量变化
(3)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
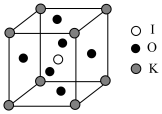
(4)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)有下列六种物质:①C60晶体 ②金刚石 ③Na2O晶体 ④CaF2晶体 ⑤P4O10晶体 ⑥碳化硅晶体。其中属于离子晶体的是___________ (填序号,下同),属于分子晶体的是___________ 。
(2)铜及其化合物在日常生产、生活中有着广泛的应用。
①向盛有硫酸铜溶液的试管里加入氨水,先形成难溶物;继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,请写出难溶物溶解过程中发生反应的离子方程式_______________ ;再加入乙醇,析出深蓝色晶体。下列对此现象说法正确的是___________
A.深蓝色溶液中的Cu2+的浓度与硫酸铜溶液中的Cu2+浓度相同
B.深蓝色晶体中的阴阳离子构型都为正四面体形
C.[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3分子中的N原子提供孤对电子
D.加入乙醇后,能析出深蓝色晶体,是因为乙醇的极性较大
E.NH3与Cu2+形成的配位键比H2O与Cu2+形成的配位键更稳定
②含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。___________ 。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
③一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于晶胞顶点;该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 (见下图)的结构相似,该晶体储氢后的化学式应为
(见下图)的结构相似,该晶体储氢后的化学式应为___________ 。
(1)有下列六种物质:①C60晶体 ②金刚石 ③Na2O晶体 ④CaF2晶体 ⑤P4O10晶体 ⑥碳化硅晶体。其中属于离子晶体的是
(2)铜及其化合物在日常生产、生活中有着广泛的应用。
①向盛有硫酸铜溶液的试管里加入氨水,先形成难溶物;继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,请写出难溶物溶解过程中发生反应的离子方程式
A.深蓝色溶液中的Cu2+的浓度与硫酸铜溶液中的Cu2+浓度相同
B.深蓝色晶体中的阴阳离子构型都为正四面体形
C.[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3分子中的N原子提供孤对电子
D.加入乙醇后,能析出深蓝色晶体,是因为乙醇的极性较大
E.NH3与Cu2+形成的配位键比H2O与Cu2+形成的配位键更稳定
②含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
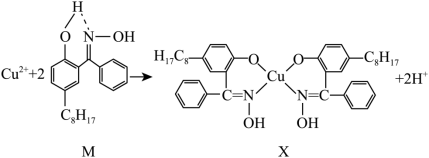
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
③一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于晶胞顶点;该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与
 (见下图)的结构相似,该晶体储氢后的化学式应为
(见下图)的结构相似,该晶体储氢后的化学式应为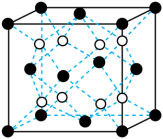
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】磷及其化合物在工业生产和科研领域有重要的用途。回答下列问题:
(1)基态P原子价层电子排布图为__________________ 。
(2)研究发现固态 结构中存在
结构中存在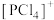 和
和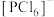 ,则
,则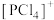 的空间构型为
的空间构型为______________ ; 属于
属于_________ (填“离子”或“分子”)晶体;研究固态 时又发现固态
时又发现固态 存在
存在 和
和 ,则固态
,则固态 结构中不存在
结构中不存在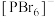 的原因是
的原因是__________________________ 。
(3)N-(膦酰甲基)亚氨基二乙酸结构如图所示。
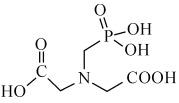
①组成元素中,属于第二周期的元素电负性由大到小的顺序为________ (填元素符号,下同)。
②组成元素中第一电离能最大的是_________ 。
③ 、
、 的组成结构相似,
的组成结构相似, 的相对分子质量大,熔沸点反而降低的原因是
的相对分子质量大,熔沸点反而降低的原因是____________________ 。
(4)磷元素与硼元素组成的一种半导体无机化合物材料,其晶胞结构如图所示,属于立方晶系。晶胞边长为a nm,阿伏加德罗常数的值为 。
。
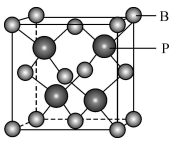
①该晶体的化学式为______________ ;
②计算该晶体的密度
_________  。
。
(1)基态P原子价层电子排布图为
(2)研究发现固态
 结构中存在
结构中存在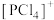 和
和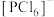 ,则
,则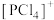 的空间构型为
的空间构型为 属于
属于 时又发现固态
时又发现固态 存在
存在 和
和 ,则固态
,则固态 结构中不存在
结构中不存在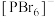 的原因是
的原因是(3)N-(膦酰甲基)亚氨基二乙酸结构如图所示。

①组成元素中,属于第二周期的元素电负性由大到小的顺序为
②组成元素中第一电离能最大的是
③
 、
、 的组成结构相似,
的组成结构相似, 的相对分子质量大,熔沸点反而降低的原因是
的相对分子质量大,熔沸点反而降低的原因是(4)磷元素与硼元素组成的一种半导体无机化合物材料,其晶胞结构如图所示,属于立方晶系。晶胞边长为a nm,阿伏加德罗常数的值为
 。
。
①该晶体的化学式为
②计算该晶体的密度

 。
。
您最近一年使用:0次



