名校
解题方法
1 . 锂离子电池的开发与应用是新能源汽车走向实用的关键。
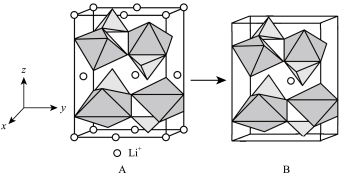
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为___________ 。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B为___________ 过程(填“充电”或“放电”)。 )。
)。
① 的键角
的键角___________ (填“等于”大于”或“小于”) 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为___________ 。
②Htrz分子为平面结构,N原子的杂化轨道类型为___________ ,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是___________ 。
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是___________ 。
(4)LiAsF6、LiPF6、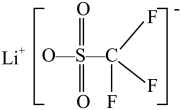 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是___________ 。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为
 )。
)。①
 的键角
的键角 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为②Htrz分子为平面结构,N原子的杂化轨道类型为
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是
(4)LiAsF6、LiPF6、
 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
您最近一年使用:0次
2024-03-16更新
|
295次组卷
|
2卷引用:河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题
名校
解题方法
2 . I.分子人工光合作用的光捕获原理如图所示,WOC1是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC1是析氢催化剂HEC在析氢过程中产生的中间体。
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)。_____ mol。
(3)NO 的VSEPR模型为
的VSEPR模型为_______ ,比较NO 、NO
、NO 键角的大小:NO
键角的大小:NO
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。_____ molSi-O键。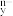 ,其可能结构如图所示,则该硅酸根化学式为
,其可能结构如图所示,则该硅酸根化学式为_______ 。
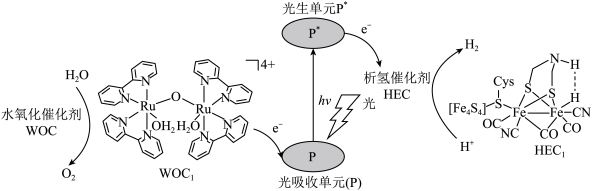
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是
a.[Ar]  b.[Ar]
b.[Ar] 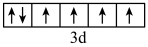
c.[Ar]  d.[Ar]
d.[Ar] 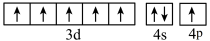
(3)NO
 的VSEPR模型为
的VSEPR模型为 、NO
、NO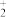 键角的大小:NO
键角的大小:NO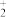
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。Ⅱ.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以表示成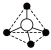 ,其中
,其中 表示氧原子,中心
表示氧原子,中心 表示硅原子,其俯视图为
表示硅原子,其俯视图为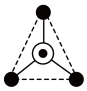 。
。

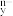 ,其可能结构如图所示,则该硅酸根化学式为
,其可能结构如图所示,则该硅酸根化学式为 
您最近一年使用:0次
2024-02-27更新
|
221次组卷
|
2卷引用:河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题
名校
解题方法
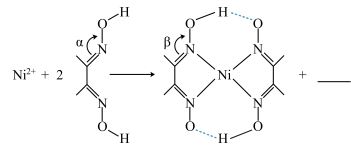
3 . 开发高效储氢材料是重要的研究方向。回答下列问题:
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态 原子的电子排布式为
原子的电子排布式为___________ 。
②石墨烯中碳碳键长___________ 乙烯中碳碳键长(填“>”“<”或“=”。)
③下列反应常用来检验,请补全方程式:_______ 
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)镧(La)和氢原子可以形成一系列储氢晶体材料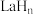 ,
,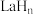 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有___________ 种,晶胞中La原子个数与正四面体空隙数之比为___________ ,H原子的配位数为___________ 。
②高压下, 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为___________ (x用数字表示)。若 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为___________ pm(用含a和b的式子表示)。
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态
 原子的电子排布式为
原子的电子排布式为②石墨烯中碳碳键长
③下列反应常用来检验,请补全方程式:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)镧(La)和氢原子可以形成一系列储氢晶体材料
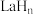 ,
,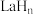 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。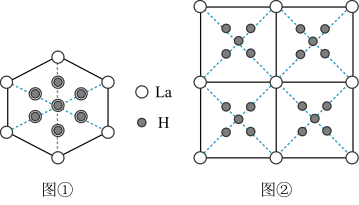
 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有②高压下,
 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为
您最近一年使用:0次
2024-02-06更新
|
574次组卷
|
2卷引用:山东省威海市2023-2024学年高三上学期期末考试化学试题
名校
解题方法
4 . 碳和硫的化合物种类繁多,应用广泛。例如CS2是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有___________ 种。基态碳原子的价电子排布是否可以表示为 ,
,___________ (填“是”或“否”),原因为___________ 。
(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有___________ (填标号)。
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角___________ (填“大于”、“小于”或“等于”)甲醛分子中H-C-H的键角,原因为___________ 。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根( )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。硫代硫酸盐用于矿石提取银时形成 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为___________ (填标号),原因为___________ 。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=___________ 。原子b的分数坐标为(0,0,0),则原子a的分数坐标为___________ 。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有
 ,
,(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根(
 )中心原子的杂化方式为
)中心原子的杂化方式为 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=

您最近一年使用:0次
2024-02-02更新
|
467次组卷
|
4卷引用:山东省青岛市黄岛区2023-2024学年高三上学期期末考试化学试题
名校
解题方法
5 . 2022年诺贝尔化学奖授子在发展点击化学方面做出贡献的科学家。点击化学的代表反应为CuCl催化的叠氮—炔基Husigen环加成反应,常用的无机试剂有 、
、 等。
等。
(1)铜在元素周期表中位置为___________ ,基态 的价电子排布式为
的价电子排布式为___________ 。
(2)N、S、O、F的第一电离能由大到小顺序为___________ 。
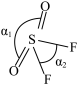
(3) 的分子结构如图所示,键角
的分子结构如图所示,键角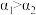 的原因主要是
的原因主要是___________ 。
(4) 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是___________ 。 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、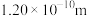 和
和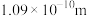 ;试画出
;试画出 分子的结构式
分子的结构式___________ 。
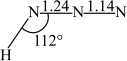
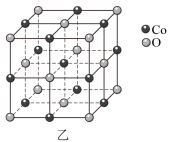
(5)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的配位数是___________ ,设 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为___________  。
。
 、
、 等。
等。(1)铜在元素周期表中位置为
 的价电子排布式为
的价电子排布式为(2)N、S、O、F的第一电离能由大到小顺序为
(3)
 的分子结构如图所示,键角
的分子结构如图所示,键角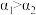 的原因主要是
的原因主要是
(4)
 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、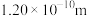 和
和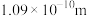 ;试画出
;试画出 分子的结构式
分子的结构式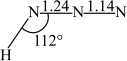
(5)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的配位数是
 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
6 . 物质的组成和结构决定了物质的性质和变化。HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
(1)Co3+基态核外电子排布式为___________ ;ClO 的空间构型的名称为
的空间构型的名称为___________ 。
(2)NH2OH分子中氮原子轨道的杂化类型是___________ 。
(3)N、H、O三种元素的电负性由小到大 的顺序为___________ 。
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对___________ ;O3和H2O的空间构型相似,正电荷中心与负电荷中心不重合,推测在H2O中的溶解度,O3比O2___________ 。(以上均选填“大”或“小”)
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
造成I3(Mn)>I3(Fe)可能的原因是___________ 。

(1)Co3+基态核外电子排布式为
 的空间构型的名称为
的空间构型的名称为(2)NH2OH分子中氮原子轨道的杂化类型是
(3)N、H、O三种元素的电负性由
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
| I1 | I2 | I3 | I4 | I5 | |
| Fe | 762 | 1562 | 2957 | 5290 | 7240 |
| Mn | 717 | 1509 | 3248 | 4940 | 6990 |
您最近一年使用:0次
2023-12-26更新
|
219次组卷
|
3卷引用:四川省泸州市泸县第一中学2023-2024学年高二上学期1月期末化学试题
名校
7 . 某化学小组模拟湿法技术,利用废旧印刷电路板,探究回收铜和制取胆矾的实验,设计流程简图如图。

请按要求回答下列问题:
(1)H2O2的电子式为_______ 。
(2)①已知反应I中Cu转化为[Cu(NH3)4]2+,则反应的化学方程式为:_______ ;在其中加入NH4Cl的作用是_______ 。
②NH3中N的杂化类型为_______ 杂化,NH3形成[Cu(NH3)4]2+后,相比NH3中H-N-H的键角变_______ 。(填“大”或“小”)
(3)操作②用到的实验仪器除烧杯外,还有_______ ,操作②的目的是_______ 。
(4)操作④主要步骤:_______ 过滤、洗涤、干燥。

请按要求回答下列问题:
(1)H2O2的电子式为
(2)①已知反应I中Cu转化为[Cu(NH3)4]2+,则反应的化学方程式为:
②NH3中N的杂化类型为
(3)操作②用到的实验仪器除烧杯外,还有
(4)操作④主要步骤:
您最近一年使用:0次
2023-08-10更新
|
44次组卷
|
3卷引用:四川省泸州市四川省泸县第五中学2023-2024学年高二上学期1月期末化学试题
解题方法
8 . 异氰酸苯酯( )是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
)是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
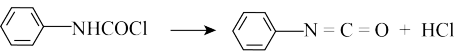
(1) 中的官能团是
中的官能团是_____ (写结构简式)。
(2)①光气(COCl2)的结构式为_____ 。
②氯元素基态原子的电子排布式为_____ 。
(3)氯吡苯脲是经国家批准使用的植物生长膨大剂之一、其结构简式为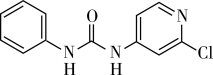 。
。
资料:异氛酸苯酯与2-氯-4-氨基吡啶反应,可生成氯吡苯脲,其反应方程式如下:
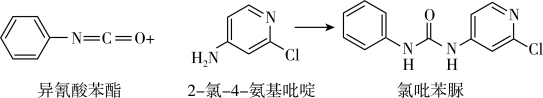 。
。
回答下列问题:
①该反应的反应类型为_____ 。
②反应过程中,每生成1个氯吡苯脲,断裂_____ 个σ键,断裂_____ 个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有NH3、CO2、H2O等。
①CO2、NH3的空间结构分别是_____ 、_____ 。
②请用共价键知识解释H2O分子比NH3分子稳定的原因_____ 。
 )是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
)是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
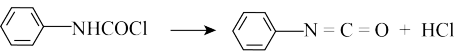
(1)
 中的官能团是
中的官能团是(2)①光气(COCl2)的结构式为
②氯元素基态原子的电子排布式为
(3)氯吡苯脲是经国家批准使用的植物生长膨大剂之一、其结构简式为
 。
。资料:异氛酸苯酯与2-氯-4-氨基吡啶反应,可生成氯吡苯脲,其反应方程式如下:
 。
。回答下列问题:
①该反应的反应类型为
②反应过程中,每生成1个氯吡苯脲,断裂
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有NH3、CO2、H2O等。
①CO2、NH3的空间结构分别是
②请用共价键知识解释H2O分子比NH3分子稳定的原因
您最近一年使用:0次
解题方法
9 . 过渡金属( 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。
(1) 的结构示意图如图-1所示。
的结构示意图如图-1所示。

①基态 的核外电子排布式为
的核外电子排布式为___________ 。
②图中 与
与 之间形成的化学键称为
之间形成的化学键称为___________ 。
③ 能与
能与 结合成
结合成 ,
, 中的键角
中的键角_______  中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)
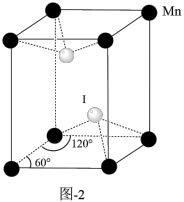
(2)锰元素能形成很多重要的化合物。
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为___________ 。
② 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为___________ 。

③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[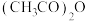 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为___________ 。已知羧酸是一大类含羧基( )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:___________ 。

 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。(1)
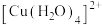 的结构示意图如图-1所示。
的结构示意图如图-1所示。
①基态
 的核外电子排布式为
的核外电子排布式为②图中
 与
与 之间形成的化学键称为
之间形成的化学键称为③
 能与
能与 结合成
结合成 ,
, 中的键角
中的键角 中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)(2)锰元素能形成很多重要的化合物。
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为

②
 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为
③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[
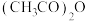 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为 )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:
您最近一年使用:0次
10 . 按要求回答下列问题。
(1)超分子的两个重要特征分别是___________(填字母)。
(2)红宝石是刚玉的一种,主要成分为氧化铝,因含微量杂质元素铬(Cr)而呈红色。基态铬原子的价层电子排布式为___________ 。
(3)键角: ,其原因是
,其原因是___________ 。
(4)①乙酸;②丙酸;③二氯乙酸的酸性由强到弱的顺序为___________ (填序号)。
(5)S与Cu形成化合物晶体的晶胞如图所示。

该晶体的化学式为___________ ,已知该晶体的密度为 ,则该晶胞的体积为
,则该晶胞的体积为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)超分子的两个重要特征分别是___________(填字母)。
| A.自组装 | B.分子识别 |
| C.以分子间作用力聚集 | D.超分子很大 |
(3)键角:
 ,其原因是
,其原因是(4)①乙酸;②丙酸;③二氯乙酸的酸性由强到弱的顺序为
(5)S与Cu形成化合物晶体的晶胞如图所示。

该晶体的化学式为
 ,则该晶胞的体积为
,则该晶胞的体积为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次



