解题方法
1 . 铁、钴、镍并称铁系元素,性质具有相似性。
(1)基态钴原子的核外电子排布式为___________ 。
(2)①铁氰化钾 溶液可以检验
溶液可以检验 ,
, 中含有
中含有 键的数目为
键的数目为___________ (设 为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括
为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括___________ 。
a. 离子键 b. 共价键 c. 配位键 d. 金属键 e. 氢键 f. 范德华力
②向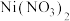 溶液中滴加氨水,刚开始时生成绿色
溶液中滴加氨水,刚开始时生成绿色 沉淀,当氨水过量时,沉淀会溶解,生成
沉淀,当氨水过量时,沉淀会溶解,生成 蓝色溶液,则
蓝色溶液,则 含有的
含有的 键的物质的量为
键的物质的量为___________ mol。
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为___________ ,碳原子的杂化类型为___________ 。
(4)NiO、FeO的晶体结构类型均与氯化钠的相同, 和
和 的离子半径分别为
的离子半径分别为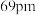 和
和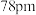 ,则熔点NiO
,则熔点NiO___________ (填“<”或“>”)FeO,判断依据是___________ 。
(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A为(0,0,0)、B为 ( ,
, ,
, )、C为(0,1,1),则D原子的坐标参数为
)、C为(0,1,1),则D原子的坐标参数为___________ 。
②若该晶体的密度是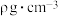 ,则晶胞中两个距离最近的Fe原子的核间距为
,则晶胞中两个距离最近的Fe原子的核间距为___________ cm。(用含 的代数式表示,不必化简,设
的代数式表示,不必化简,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
(1)基态钴原子的核外电子排布式为
(2)①铁氰化钾
 溶液可以检验
溶液可以检验 ,
, 中含有
中含有 键的数目为
键的数目为 为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括
为阿伏加德罗常数的值),铁氰化钾晶体中各种粒子间的相互作用不包括a. 离子键 b. 共价键 c. 配位键 d. 金属键 e. 氢键 f. 范德华力
②向
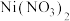 溶液中滴加氨水,刚开始时生成绿色
溶液中滴加氨水,刚开始时生成绿色 沉淀,当氨水过量时,沉淀会溶解,生成
沉淀,当氨水过量时,沉淀会溶解,生成 蓝色溶液,则
蓝色溶液,则 含有的
含有的 键的物质的量为
键的物质的量为(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,
 和
和 的离子半径分别为
的离子半径分别为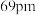 和
和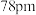 ,则熔点NiO
,则熔点NiO(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A为(0,0,0)、B为 (
 ,
, ,
, )、C为(0,1,1),则D原子的坐标参数为
)、C为(0,1,1),则D原子的坐标参数为②若该晶体的密度是
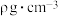 ,则晶胞中两个距离最近的Fe原子的核间距为
,则晶胞中两个距离最近的Fe原子的核间距为 的代数式表示,不必化简,设
的代数式表示,不必化简,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
2 . 请回答下列问题。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式_________ 。
②按照核外电子排布,可把元素周期表划分为5个区, 在元素周期表中属于
在元素周期表中属于_________ 区。
(2)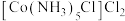 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_________ 形,是_________ (填“极性”或“非极性)分子。
② 的价层电子轨道表示式是
的价层电子轨道表示式是_________ 。
③ 中含有的
中含有的 键的数目为
键的数目为_________ (用 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。
④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取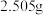 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液,_________ (补全实验操作),称量沉淀质量为_________ (精确到 ,相对分子质量
,相对分子质量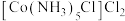 :250.5;
:250.5; :143.5) 。
:143.5) 。
(3)第ⅤA族元素及其化合物的结构和性质如下:
① 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_________ (填化学式,下同),键角由大到小的顺序为_________ 。
②某一种氮化硼晶体的立方晶胞结构如图:
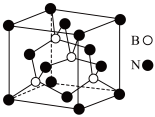
i.氮化硼 属于
属于_________ 晶体;该种氮化硼 的熔点
的熔点_________  (填>、<、=)。
(填>、<、=)。
ii.已知氮化硼 晶胞的边长为
晶胞的边长为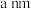 ,则晶胞密度为
,则晶胞密度为_________  (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式
②按照核外电子排布,可把元素周期表划分为5个区,
 在元素周期表中属于
在元素周期表中属于(2)
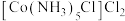 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②
 的价层电子轨道表示式是
的价层电子轨道表示式是③
 中含有的
中含有的 键的数目为
键的数目为 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
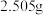 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液, ,相对分子质量
,相对分子质量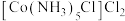 :250.5;
:250.5; :143.5) 。
:143.5) 。(3)第ⅤA族元素及其化合物的结构和性质如下:
①
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为②某一种氮化硼晶体的立方晶胞结构如图:

i.氮化硼
 属于
属于 的熔点
的熔点 (填>、<、=)。
(填>、<、=)。ii.已知氮化硼
 晶胞的边长为
晶胞的边长为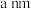 ,则晶胞密度为
,则晶胞密度为 (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
3 . 溴化锂(LiBr)是一种高效空气湿度调节剂;碘化钠(NaI)可用于医用祛痰剂等。它们可利用单质直接化合、氢氧化物和氢卤酸中和等反应合成。
(1)工业上以碳酸锂为原料制备 晶体的流程如下:
晶体的流程如下:
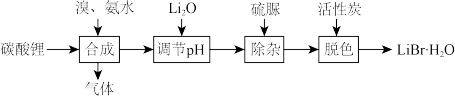
①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为___________ 。
②加还原剂硫脲 除去可能含有的
除去可能含有的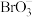 ,
, 共有
共有___________ molσ键。
③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取 晶体的操作有:在HBr氛围下蒸发浓缩、
晶体的操作有:在HBr氛围下蒸发浓缩、___________ ,___________ ,洗涤后烘干。

(2)某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。

药品: 溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,___________,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和 的离子方程式为
的离子方程式为___________ 。
②设计合理方案,补充完整上述实验步骤:___________ 。
(1)工业上以碳酸锂为原料制备
 晶体的流程如下:
晶体的流程如下:
①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为
②加还原剂硫脲
 除去可能含有的
除去可能含有的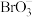 ,
, 共有
共有③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取
 晶体的操作有:在HBr氛围下蒸发浓缩、
晶体的操作有:在HBr氛围下蒸发浓缩、
(2)某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。

药品:
 溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,___________,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和
 的离子方程式为
的离子方程式为②设计合理方案,补充完整上述实验步骤:
您最近一年使用:0次
名校
解题方法
4 . 全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近一年使用:0次
2022-04-14更新
|
1935次组卷
|
11卷引用:新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(全国甲卷)广东省茂名市普通高中毕业班2022届高三下学期模拟考试化学试题北京市第二中学2022届高三下学期五月模拟考试化学试题广东省广州市第六中学2022届高三第三次模拟考试化学试题广西南宁市第二中学2021-2022学年高三下学期收网题理综化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题
名校
5 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述错误的是


A.56 gFe参加反应,共有NA个S2O 被还原 被还原 |
| B.1 mol过硫酸钠(Na2S2O8)含NA个过氧键 |
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO ·+OH-=SO ·+OH-=SO +·OH +·OH |
| D.pH越小,越不利于去除废水中的正五价砷 |
您最近一年使用:0次
2021-02-02更新
|
1042次组卷
|
10卷引用:安徽省芜湖市2021届高三上学期期末考试理综化学试题
安徽省芜湖市2021届高三上学期期末考试理综化学试题山东省枣庄滕州市2021-2022学年高三上学期期中考试化学试题河南省南阳市第一中学校2022届高三上学期第四次月考化学试题山东省济南外国语学校(三箭分校)2021-2022学年高三上学期模拟考试化学试题河南省示范性高中2021-2022学年高三上学期阶段性调研联考二化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)冲刺卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题河北省魏县第五中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
6 . 2019年是国际纯粹与应用化学联合会(IUPAC)成立一百周年,也是元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)Fe3+基态核外电子排布式为____________________ 。
(2)加碘食盐中含有KIO3,其立体结构如图,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置。K与O间的最短距离为____ nm,与K紧邻的I个数为______ 。
(3)下列有关性质的比较,能用元素周期律解释的是______ 。
a 酸性: b 非金属性:O>S
b 非金属性:O>S
c 碱性: d 热稳定性:
d 热稳定性:
(4)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是________ ,1 mol 乙醇分子中含有σ键的数目为_________ 。
(5)原子坐标参数表示晶胞内各原子的相对位置。如图(晶胞中,原子坐标参数A为(0,0,0);B为( ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为________ 。

(1)Fe3+基态核外电子排布式为
(2)加碘食盐中含有KIO3,其立体结构如图,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置。K与O间的最短距离为

(3)下列有关性质的比较,能用元素周期律解释的是
a 酸性:
 b 非金属性:O>S
b 非金属性:O>S c 碱性:
 d 热稳定性:
d 热稳定性:
(4)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是
(5)原子坐标参数表示晶胞内各原子的相对位置。如图(晶胞中,原子坐标参数A为(0,0,0);B为(
 ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为
您最近一年使用:0次
解题方法
7 . 三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。
回答下列问题:
(1)基态Ge原子价电子排布图为_______ ,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得______ 光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是______ 。
②推测 1molGenH2n+2中含有的σ键的数目是_____ (用NA表示阿伏加 德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中 EMIM+结构如图所示。

①该物质的晶体类型是_________ 。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是________ 。
(4)独立的NH3分子中H-N-H 的键角为 107.3 º ,[Zn(NH3)6]2+离子中H-N-H的键角________ 107.3° ( 填“大于”、“小于”或“等于” )。
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_____ ;已知晶胞边长为a pm,乙图为甲图的俯视图,A点坐标为( 0,0,0),B点坐标为(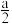 ,a,
,a,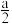 ) ,则 D点坐标为
) ,则 D点坐标为_______ ;若该晶胞密度为ρ g·cm-3,则阿伏加 德罗常数NA为_______ (列出计算式)。

回答下列问题:
(1)基态Ge原子价电子排布图为
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是
②推测 1molGenH2n+2中含有的σ键的数目是
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中 EMIM+结构如图所示。

①该物质的晶体类型是
②EMIM+ 离子中组成元素的电负性由小到大的顺序是
(4)独立的NH3分子中H-N-H 的键角为 107.3 º ,[Zn(NH3)6]2+离子中H-N-H的键角
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
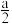 ,a,
,a,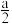 ) ,则 D点坐标为
) ,则 D点坐标为
您最近一年使用:0次
2020-07-11更新
|
208次组卷
|
2卷引用:山东省济宁市2019-2020学年高二下学期期末考试化学试题



