名校
解题方法
1 . 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
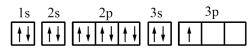
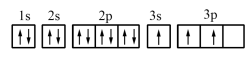
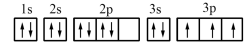
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.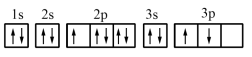
其中能量最低的是_______ (填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______ ;H2S的键角比H2O的键角_______ (填“大”或“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
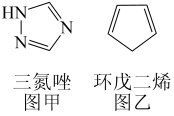
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______ ;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
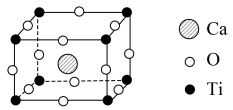
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是_______ cm(已知晶胞参数为anm)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.
其中能量最低的是
(2)C、O、N 原子的第一电离能由大到小的顺序为
(3)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2023-08-27更新
|
71次组卷
|
2卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高三上学期1月期末化学试题
2 . 已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的价层电子排布图___ 。
(2)B、C、D三种元素的电负性由大到小的顺序为___ (写元素符号)。
(3)E与C以1:1形成的物质的电子式为___ 。该物质与BC2反应的化学方程式为___ 。
(4)用电子式表示BC2形成过程___ 。
(5)E元素焰色反应的原因是___ 。
(6)用VSEPR理论判断DC3分子的空间立体结构为___ 。
(7)上述元素中第一电离能最大的元素是___ (填元素符号)。
(1)写出A元素基态原子的价层电子排布图
(2)B、C、D三种元素的电负性由大到小的顺序为
(3)E与C以1:1形成的物质的电子式为
(4)用电子式表示BC2形成过程
(5)E元素焰色反应的原因是
(6)用VSEPR理论判断DC3分子的空间立体结构为
(7)上述元素中第一电离能最大的元素是
您最近一年使用:0次
名校
解题方法
3 . 氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
| A.平面三角形 sp2杂化 | B.V形 sp2杂化 |
| C.三角锥形 sp3杂化 | D.直线形 sp杂化 |
您最近一年使用:0次
2019-06-23更新
|
321次组卷
|
11卷引用:吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题
吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题2014-2015辽宁省葫芦岛市高二下学期市五校协作体期中化学试卷2016届河南省郑州市第一中学新高三年级调研检测化学试卷辽宁省辽河油田第二高级中学2018-2019学年高二下学期期中考试化学试题(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题吉林省实验中学2021-2022学年高二下学期线上质量检测化学试题第二章 本章复习提升2湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题湖北省黄冈市麻城市第二中学2021-2022学年高二下学期3月月考化学试题 吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题
4 . 下列说法中错误的是
| A.当中心原子的配位数为6时,中心原子和配体构成的配离子常呈八面体空间结构 |
| B.CO32-为平面正三角形结构 |
| C.若已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它的空间构型为直线型 |
| D.配位数为4的配合物均为正四面体结构 |
您最近一年使用:0次
5 . 用价层电子对互斥理论预测SO32-和BF3的空间构型,结论正确的是 ( )
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.三角锥形;平面三角形 | D.直线形;平面三角形 |
您最近一年使用:0次
2018-04-06更新
|
139次组卷
|
2卷引用:吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题
6 . 下列关于砷(As)元素的叙述中,正确的是
| A.第一电离能:As<Se,电负性As<Se |
| B.在AsCl3分子中,砷和氯原子核外电子数均为8 |
| C.砷酸的酸性比亚砷酸强,且砷酸钠溶液呈碱性 |
| D.AsH3的VSEPR模型为三角锥形,其中As原子采取sp3杂化 |
您最近一年使用:0次
2018-04-06更新
|
156次组卷
|
2卷引用:吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题
7 . W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________ (填元素符号);Q原子的价电子排布式为________ ;
(2)Z元素在周期表中的位置为___________________ 。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
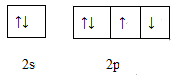
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________ 。
(6)写出上问中N的电子式:__________________________
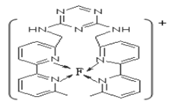
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________ 。
(1)W、X、Y、Z四种元素中第一电离能最小的是
(2)Z元素在周期表中的位置为
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则

(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为
(6)写出上问中N的电子式:
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有

您最近一年使用:0次
名校
8 . 下列分子中,各原子均处于同一平面上的是( )
| A.NH3 | B.CCl4 | C.PCl3 | D.CH2O |
您最近一年使用:0次
2018-02-12更新
|
232次组卷
|
4卷引用:吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题
吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第1课时(已下线)模块同步卷05 分子的立体构型及分子的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题
名校
9 . 下列说法正确的是
| A.VSEPR模型就是分子的空间构型 |
| B.在共价化合物分子中一定存在σ键 |
| C.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 |
| D.共价键键长越短,键能一定越大 |
您最近一年使用:0次
2017-06-24更新
|
202次组卷
|
6卷引用:吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题
名校
解题方法
10 . 前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸(本题中出现的 B 、 C 均为字母,不是元素符号 )。
(1)D元素基态原子的外围电子排布式为____________________ 。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________ (用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________ (用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是___ 。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式_____________________________ 。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如下图所示)中F原子的配位数之比为___________ ,δ、γ、α三种晶胞的边长之比为_____________ 。
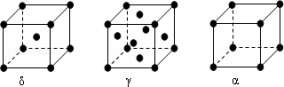
(1)D元素基态原子的外围电子排布式为
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为
(3)B、X、D氢化物的沸点由高到低的顺序为
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
| 微粒 | CO32- | CO42- |
| 立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如下图所示)中F原子的配位数之比为

您最近一年使用:0次
2017-05-24更新
|
469次组卷
|
4卷引用:吉林省辽源市第五中学2016-2017学年高二下学期第二次月考化学试题



