名校
1 . 回答下列问题。
(1) 中,
中, 的轨道杂化方式为
的轨道杂化方式为___________ ;列举与 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:___________ 、___________ (填化学式)。
(2)用价电子对互斥理论推断 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ , 分子中
分子中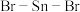 的键角
的键角___________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)下列物质中具有旋光性的是___________(填标号)。
(1)
 中,
中, 的轨道杂化方式为
的轨道杂化方式为 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:(2)用价电子对互斥理论推断
 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为 分子中
分子中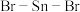 的键角
的键角 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)下列物质中具有旋光性的是___________(填标号)。
A.乙醇( ) ) | B.1,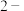 二氧丙烷( 二氧丙烷( ) ) |
C.乙酸( ) ) | D.乳酸(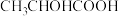 ) ) |
您最近一年使用:0次
名校
解题方法
2 . 工业上可以用NaCl溶液制取重要的化工原料纯碱,此化工流程还需要一定量的CO2和NH3。
(1)NH3的分子构型是_______ ,用电子式表示NH3分子的形成过程_______ 。
(2)工业上合成氨气需要使用氮气,氮原子的结构示意图是_______ ,氮气分子的结构式是_______ 。
(3)羰基硫COS的分子构型与CO2分子相似,可以看作CO2分子中的1个氧原子被硫原子取代。COS的电子式是_______ ,它是_______ (填“极性”或“非极性”)分子。
(1)NH3的分子构型是
(2)工业上合成氨气需要使用氮气,氮原子的结构示意图是
(3)羰基硫COS的分子构型与CO2分子相似,可以看作CO2分子中的1个氧原子被硫原子取代。COS的电子式是
您最近一年使用:0次
3 . 下列说法正确的是
| A.两个p轨道不能形成σ键,只能形成π键 |
| B.键角是两个相邻共价键之间的夹角,说明共价键具有方向性 |
| C.NF3的VSEPR模型为正四面体且其空间结构为V形 |
D.氧原子可以形成 、 、 ,也可能形成 ,也可能形成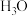 |
您最近一年使用:0次
名校
4 . 下列有关配合物 的说法正确的是
的说法正确的是
 的说法正确的是
的说法正确的是A.配体中的 的沸点比 的沸点比 的低 的低 |
B.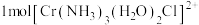 中 中 键的数目为 键的数目为 |
C. 中 中 的键角大于 的键角大于 中 中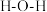 的键角 的键角 |
D.向其中分别滴加 溶液、 溶液、 溶液,则分别生成 溶液,则分别生成 、 、 两种白色沉淀 两种白色沉淀 |
您最近一年使用:0次
名校
解题方法
5 . 根据价层电子对互斥理论的分析,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。下列关于键角的比较不正确 的是
A.甲醛(HCHO)和光气(COCl2)分子中:键角 |
B.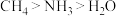 |
C.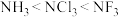 |
D. |
您最近一年使用:0次
6 . SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是
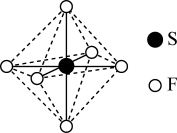
| A.是非极性分子 | B.键角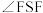 都等于90° 都等于90° |
C. 与 与 之间共用电子对偏向S 之间共用电子对偏向S | D. 原子满足8电子稳定结构 原子满足8电子稳定结构 |
您最近一年使用:0次
2021-10-23更新
|
8356次组卷
|
32卷引用:重庆市第一中学校2023-2024学年高一下学期定时练习化学试题
重庆市第一中学校2023-2024学年高一下学期定时练习化学试题2021年新高考海南化学高考真题2021年海南高考化学试题变式题1-10(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省厦门市第一中学2021-2022学年高二下学期3月适应性练习化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题(已下线)秘籍03 化学用语-备战2022年高考化学抢分秘籍(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题辽宁省大石桥市第三高级中学2021-2022学年高三12月月考化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)巩固训练7(已下线)题型91 分子的极性与共价键的极性判断浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)第21讲分子结构与性质(已下线)第4讲 空间构型(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海中学东校2023-2024学年高三上学期9月月考化学试题海南省文昌中学2023-2024学年高二下学期第一次月考化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
解题方法
7 . 1824年,德国化学家维勒蒸发氰酸铵( )溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素
)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素 一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析: 与
与 的关系为
的关系为___________ 。
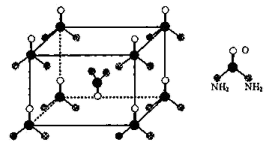
(2)尿素晶体的晶胞结构如图所示,该晶胞中有___________ 个尿素分子。
(3)硝酸铁和尿素在乙醇溶液中可以合成 [三硝酸六尿素合铁(Ⅲ)]。
[三硝酸六尿素合铁(Ⅲ)]。
①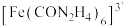 中基态中心离子的核外电子排布式是
中基态中心离子的核外电子排布式是___________ , 的空间结构是
的空间结构是___________ 。
②实验发现,其他条件相同时,乙醇溶液浓度越大,析出的三硝酸六尿素合铁(Ⅲ)晶体越多。其原因是___________ 。
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。 元素的第一电子亲和能远低于
元素的第一电子亲和能远低于 元素的原因是
元素的原因是___________ 。
 )溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素
)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素 一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析:
 与
与 的关系为
的关系为(2)尿素晶体的晶胞结构如图所示,该晶胞中有
(3)硝酸铁和尿素在乙醇溶液中可以合成
 [三硝酸六尿素合铁(Ⅲ)]。
[三硝酸六尿素合铁(Ⅲ)]。①
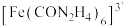 中基态中心离子的核外电子排布式是
中基态中心离子的核外电子排布式是 的空间结构是
的空间结构是②实验发现,其他条件相同时,乙醇溶液浓度越大,析出的三硝酸六尿素合铁(Ⅲ)晶体越多。其原因是
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。
 元素的第一电子亲和能远低于
元素的第一电子亲和能远低于 元素的原因是
元素的原因是
您最近一年使用:0次
解题方法
8 . (1) CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是____ 。与NH3分子互为等电子体的阴离子为____ 。
(2) 乳酸分子(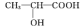 )中C原子的杂化类型为
)中C原子的杂化类型为____ 。与 互为等电子体的一种分子化学式为
互为等电子体的一种分子化学式为_____ 。
(3) 的空间构型为
的空间构型为________ (用文字描述);NaNT可由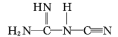 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ 。
(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是____ ;与SiF4互为等电子体的阴离子的化学式为_______ 。
(5) 中N原子轨道的杂化类型是
中N原子轨道的杂化类型是___ 。与 互为等电子体的一种分子为
互为等电子体的一种分子为__ (填化学式)。
(6)苯甲醇(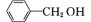 )中碳原子的杂化轨道类型为
)中碳原子的杂化轨道类型为______ 。与 互为等电子体的阳离子为
互为等电子体的阳离子为______ (填化学式), 离子的空间构型为(用文字描述)
离子的空间构型为(用文字描述)________ 。
(2) 乳酸分子(
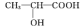 )中C原子的杂化类型为
)中C原子的杂化类型为 互为等电子体的一种分子化学式为
互为等电子体的一种分子化学式为(3)
 的空间构型为
的空间构型为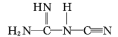 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为(4)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
(5)
 中N原子轨道的杂化类型是
中N原子轨道的杂化类型是 互为等电子体的一种分子为
互为等电子体的一种分子为(6)苯甲醇(
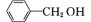 )中碳原子的杂化轨道类型为
)中碳原子的杂化轨道类型为 互为等电子体的阳离子为
互为等电子体的阳离子为 离子的空间构型为(用文字描述)
离子的空间构型为(用文字描述)
您最近一年使用:0次
解题方法
9 . 有关NH3分子的结构分析正确的是
| A.中心原子孤电子对数为0,分子为平面三角形,键角为120° |
| B.中心原子孤电子对数为0,分子为三角锥形,键角为107° |
| C.中心原子孤电子对数为1,分子为三角锥形,键角为107° |
| D.中心原子孤电子对数为1,分子为平面三角形,键角为109°28′ |
您最近一年使用:0次
解题方法
10 . LiAlH4是有机合成中常用的还原剂,可在乙醚中制得:4LiH+AlCl3=LiAlH4+3LiCl。下列说法错误的是
| A.Li+半径大于H-半径 |
| B.[AlH4]-空间构型是正四面体 |
| C.LiAlH4中存在离子键、σ键、配位键 |
| D.Al2Cl6为AlCl3的双聚分子,氯原子提供给铝原子孤对电子 |
您最近一年使用:0次
2021-05-19更新
|
164次组卷
|
2卷引用:重庆市缙云联盟2021-2022学年高一10月质量检测化学试题



