解题方法
1 . 卤族元素的化合物在科研和生产中有着重要的作用。请回答下列问题:
(1) (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为______ ;
______ (填“是”或“否”)具有极性;基态碘原子价电子排布式为______ 。
(2)物质磁性大小以磁矩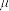 表示,
表示,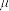 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: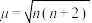 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为______ 。
a. b.
b. c.
c.
配合物 中配离子
中配离子 的
的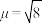 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为______ 。
(3)在极高压强下,氯化钠可以和氯气化合生成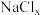 。
。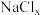 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为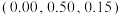 、
、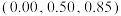 ,晶体的化学式为
,晶体的化学式为______ ;与Na距离最近的且相等的Cl有______ 个; 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为______ nm(保留2位有效数字)。
(1)
 (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为
(2)物质磁性大小以磁矩
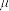 表示,
表示,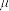 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: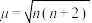 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为a.
 b.
b. c.
c.
配合物
 中配离子
中配离子 的
的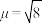 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为(3)在极高压强下,氯化钠可以和氯气化合生成
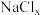 。
。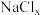 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为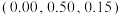 、
、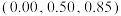 ,晶体的化学式为
,晶体的化学式为 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为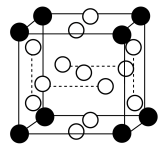
您最近一年使用:0次
解题方法
2 . Ⅰ.铊(T1)盐与氰化钾 被列为
被列为 级危险品,常用普鲁士蓝作为解毒剂.
级危险品,常用普鲁士蓝作为解毒剂.
(1)写出铊的价电子排布式:___________ 。
(2)向 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到 普鲁士蓝蓝色晶体,实验表明,
普鲁士蓝蓝色晶体,实验表明, 通过配位键构成了晶体的骨架,其局部结构如图1所示,记为Ⅰ型立方结构,将Ⅰ型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2所示,记为Ⅱ型立方结构,下层左后方的小立方体
通过配位键构成了晶体的骨架,其局部结构如图1所示,记为Ⅰ型立方结构,将Ⅰ型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2所示,记为Ⅱ型立方结构,下层左后方的小立方体 未标出)。
未标出)。 )有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因:
)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因:___________ ;
②若 位于Ⅱ型立方结构的棱心和体心上,则
位于Ⅱ型立方结构的棱心和体心上,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的___________ 上;若 的摩尔质量为
的摩尔质量为 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,Ⅱ型立方结构的边长为
,Ⅱ型立方结构的边长为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (用含 的代数式表示)。
的代数式表示)。
Ⅱ.铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性好,主要用于航天航空仪表、电子钟表、磁控管等。
(3)二氯二吡啶合铂是由 和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图所示).科学研究表明,其顺式分子具有抗癌活性.
和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图所示).科学研究表明,其顺式分子具有抗癌活性. 键
键 ,吡啶中
,吡啶中 原子的价层孤电子对占据
原子的价层孤电子对占据___________ 轨道。
②二氯二吡啶合铂分子中存在的微粒间作用力有___________ (填选项字母)。
a.离子键 b.配位键 c.金属键
d.非极性键 e.氢键 f.极性键
③反式二氯二吡啶合铂分子是___________ (填“极性分子”或“非极性分子”)。
(4)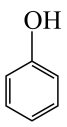 、
、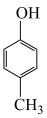 、
、 的酸性随羟基极性的增大而增强,则酸性从强到弱的排序为
的酸性随羟基极性的增大而增强,则酸性从强到弱的排序为___________ 。
 被列为
被列为 级危险品,常用普鲁士蓝作为解毒剂.
级危险品,常用普鲁士蓝作为解毒剂.(1)写出铊的价电子排布式:
(2)向
 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到 普鲁士蓝蓝色晶体,实验表明,
普鲁士蓝蓝色晶体,实验表明, 通过配位键构成了晶体的骨架,其局部结构如图1所示,记为Ⅰ型立方结构,将Ⅰ型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2所示,记为Ⅱ型立方结构,下层左后方的小立方体
通过配位键构成了晶体的骨架,其局部结构如图1所示,记为Ⅰ型立方结构,将Ⅰ型立方结构平移、旋转、并置,可得到晶体的晶胞(如图2所示,记为Ⅱ型立方结构,下层左后方的小立方体 未标出)。
未标出)。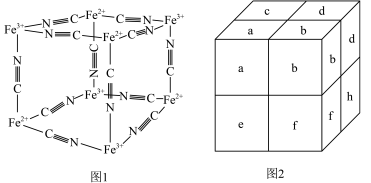
 )有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因:
)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因:②若
 位于Ⅱ型立方结构的棱心和体心上,则
位于Ⅱ型立方结构的棱心和体心上,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 的摩尔质量为
的摩尔质量为 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,Ⅱ型立方结构的边长为
,Ⅱ型立方结构的边长为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
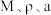 的代数式表示)。
的代数式表示)。Ⅱ.铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性好,主要用于航天航空仪表、电子钟表、磁控管等。
(3)二氯二吡啶合铂是由
 和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图所示).科学研究表明,其顺式分子具有抗癌活性.
和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图所示).科学研究表明,其顺式分子具有抗癌活性.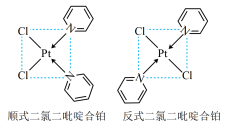
 键
键 ,吡啶中
,吡啶中 原子的价层孤电子对占据
原子的价层孤电子对占据②二氯二吡啶合铂分子中存在的微粒间作用力有
a.离子键 b.配位键 c.金属键
d.非极性键 e.氢键 f.极性键
③反式二氯二吡啶合铂分子是
(4)
 、
、 、
、 的酸性随羟基极性的增大而增强,则酸性从强到弱的排序为
的酸性随羟基极性的增大而增强,则酸性从强到弱的排序为
您最近一年使用:0次
3 . 铁及其配合物在科研、生产中有着重要的应用。回答以下问题:
(1)写出Fe在元素周期表中的位置___________ 。
(2) 能与
能与 形成
形成 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是___________ , 离子的空间构型为
离子的空间构型为___________ 。
(3)邻二氮菲(phen, )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有___________ mol配位键。某研究小组向反应后的溶液中滴加少量稀硫酸,溶液颜色变浅,简要说明原因:___________ 。
(4)配合物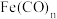 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。
①分解反应过程中断裂的化学键只有配位键,形成的化学键是___________ 。
②写出配体CO的结构式___________ ,1mol该配合物中含有的 键数目为
键数目为___________ 。
(1)写出Fe在元素周期表中的位置
(2)
 能与
能与 形成
形成 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是 离子的空间构型为
离子的空间构型为(3)邻二氮菲(phen,
 )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有(4)配合物
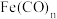 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。①分解反应过程中断裂的化学键只有配位键,形成的化学键是
②写出配体CO的结构式
 键数目为
键数目为
您最近一年使用:0次
名校
解题方法
4 .  是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:
(1) 为
为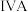 族元素,单质
族元素,单质 与干燥
与干燥 反应生成
反应生成 。常温常压下
。常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为___________ ,其固体的晶体类型为___________ 。
(2) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ (填化学式,下同),键角由大到小的顺序为___________
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为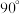 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
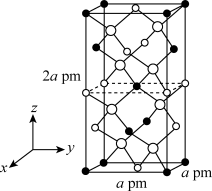
找出距离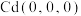 最近的Sn
最近的Sn_____ (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有______ 个。
 是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:(1)
 为
为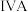 族元素,单质
族元素,单质 与干燥
与干燥 反应生成
反应生成 。常温常压下
。常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(2)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为
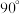 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。| 坐标原子 | X | y | Z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |

找出距离
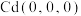 最近的Sn
最近的Sn
您最近一年使用:0次
名校
解题方法
5 . I.工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(1)FeSO4·7H2O结构示意图如图:
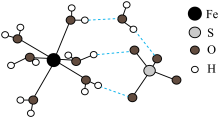
①Fe2+的价层电子排布式为_____ 。
②H2O中O和SO 中S均为sp3杂化,比较H2O中H-O-H键角和SO
中S均为sp3杂化,比较H2O中H-O-H键角和SO 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因____ 。
③FeSO4·7H2O中H2O与Fe2+、H2O与SO 的作用力类型分别是
的作用力类型分别是_____ 。
(2)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图:
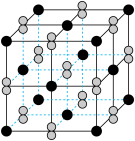
①Fe2+的配位数_____ 个。
②FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数为NA,晶体的密度为_____ g•cm-3。(1nm=10—9m)
Ⅱ.四氟肼(N2F4)可作高能燃料的氧化剂,可用Fe3+与二氟胺(HNF2)反应制得,发生的反应是2HNF2+2Fe3+=N2F4↑+2Fe2++2H+,请回答有关问题:
(3)F原子最外层电子排布式_____ ;N原子核外不同运动状态的电子有_____ 种;N2的电子式_____ ;F元素的非金属性比N强,用原子结构的知识说明理由:_____ 。
(4)HNF2中N元素的化合价是_____ ;反应中氧化剂与还原剂的物质的量之比为_____ ;若生成0.1molN2F4,电子转移数是____ 。
(1)FeSO4·7H2O结构示意图如图:

①Fe2+的价层电子排布式为
②H2O中O和SO
 中S均为sp3杂化,比较H2O中H-O-H键角和SO
中S均为sp3杂化,比较H2O中H-O-H键角和SO 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因③FeSO4·7H2O中H2O与Fe2+、H2O与SO
 的作用力类型分别是
的作用力类型分别是(2)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图:

①Fe2+的配位数
②FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数为NA,晶体的密度为
Ⅱ.四氟肼(N2F4)可作高能燃料的氧化剂,可用Fe3+与二氟胺(HNF2)反应制得,发生的反应是2HNF2+2Fe3+=N2F4↑+2Fe2++2H+,请回答有关问题:
(3)F原子最外层电子排布式
(4)HNF2中N元素的化合价是
您最近一年使用:0次
名校
解题方法
6 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第______ 族______ 区。
(2)离子ZW 的空间结构为:
的空间结构为:___________ ;化合物X2W的价层电子对互斥模型为___________ 。
(3)比较ZX 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
_____ (填“>”“=”或“<”)ZX3。
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有___________ ,该化合物中σ键和π键的个数之比为___________ 。
| X元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层电子 |
| Z元素基态原子的未成对电子数目是同周期最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)离子ZW
 的空间结构为:
的空间结构为:(3)比较ZX
 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有
您最近一年使用:0次
2023-03-14更新
|
110次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
解题方法
7 . 回答下列问题:
(1)黄铜是由铜和锌组成的合金,其中铜的第二电离能_______ (填“大于”“小于”或“等于”)锌的第二电离能,原因是:_______ 。
(2)碳酸二甲酯( )是一种低毒、环保性能优异、用途广泛的化工原料。碳酸二甲醋分子中
)是一种低毒、环保性能优异、用途广泛的化工原料。碳酸二甲醋分子中 、π键的个数比是
、π键的个数比是_______ ,O—C—O键的键角_______ 120°(填“>”、“<”、或“=”)。
(3) 在溶液中容易与许多配体形成配离子,比如
在溶液中容易与许多配体形成配离子,比如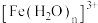 (无色),
(无色),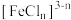 (黄色),
(黄色), (黄色),某同学为了研究
(黄色),某同学为了研究 溶液和
溶液和 溶液显黄色分别是由哪种微粒导致的,并探究影响配合物形成和制备的因素。设计如下实验,溶液中
溶液显黄色分别是由哪种微粒导致的,并探究影响配合物形成和制备的因素。设计如下实验,溶液中 与各种配体形成配离子的反应均是可逆反应。
与各种配体形成配离子的反应均是可逆反应。
a.取2支试管分别加等量的 溶液,向一支试管中加入3滴2mol/L的
溶液,向一支试管中加入3滴2mol/L的 溶液,溶液颜色无变化,向另一个试管中加3滴2mol/L的
溶液,溶液颜色无变化,向另一个试管中加3滴2mol/L的 溶液,黄色退去。说明
溶液,黄色退去。说明 溶液显黄色的原因主要是
溶液显黄色的原因主要是_______ 微粒导致的(填配体的化学式), 的加入是为了排除
的加入是为了排除_______ 微粒的影响(填化学式)。
b.取①中黄色退去的 溶液2mL于试管中,向其中加入3滴2mol/L的NaCl溶液,溶液变为黄色;另取一支试管,加入2mL黄色的
溶液2mL于试管中,向其中加入3滴2mol/L的NaCl溶液,溶液变为黄色;另取一支试管,加入2mL黄色的 溶液,继续滴加3滴2mol/L的
溶液,继续滴加3滴2mol/L的 溶液,溶液颜色无变化。说明
溶液,溶液颜色无变化。说明 溶液显黄色的主要原因是
溶液显黄色的主要原因是_______ 微粒导致的(填配体的化学式)。
c.由实验①和②可知,影响配合物形成和制备的因素有_______ 。(答出一条因素即可)
(1)黄铜是由铜和锌组成的合金,其中铜的第二电离能
(2)碳酸二甲酯(
 )是一种低毒、环保性能优异、用途广泛的化工原料。碳酸二甲醋分子中
)是一种低毒、环保性能优异、用途广泛的化工原料。碳酸二甲醋分子中 、π键的个数比是
、π键的个数比是(3)
 在溶液中容易与许多配体形成配离子,比如
在溶液中容易与许多配体形成配离子,比如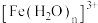 (无色),
(无色),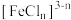 (黄色),
(黄色), (黄色),某同学为了研究
(黄色),某同学为了研究 溶液和
溶液和 溶液显黄色分别是由哪种微粒导致的,并探究影响配合物形成和制备的因素。设计如下实验,溶液中
溶液显黄色分别是由哪种微粒导致的,并探究影响配合物形成和制备的因素。设计如下实验,溶液中 与各种配体形成配离子的反应均是可逆反应。
与各种配体形成配离子的反应均是可逆反应。a.取2支试管分别加等量的
 溶液,向一支试管中加入3滴2mol/L的
溶液,向一支试管中加入3滴2mol/L的 溶液,溶液颜色无变化,向另一个试管中加3滴2mol/L的
溶液,溶液颜色无变化,向另一个试管中加3滴2mol/L的 溶液,黄色退去。说明
溶液,黄色退去。说明 溶液显黄色的原因主要是
溶液显黄色的原因主要是 的加入是为了排除
的加入是为了排除b.取①中黄色退去的
 溶液2mL于试管中,向其中加入3滴2mol/L的NaCl溶液,溶液变为黄色;另取一支试管,加入2mL黄色的
溶液2mL于试管中,向其中加入3滴2mol/L的NaCl溶液,溶液变为黄色;另取一支试管,加入2mL黄色的 溶液,继续滴加3滴2mol/L的
溶液,继续滴加3滴2mol/L的 溶液,溶液颜色无变化。说明
溶液,溶液颜色无变化。说明 溶液显黄色的主要原因是
溶液显黄色的主要原因是c.由实验①和②可知,影响配合物形成和制备的因素有
您最近一年使用:0次
解题方法
8 . 中国科学技术大学吴长征教授团队通过四烷基铵阳离子的插层及随后对合适氧化还原电位的选择,成功剥离制备出二维非范德华 纳米片。回答下列问题:
纳米片。回答下列问题:
(1)基态硫原子核外有_______ 种电子运动状态,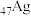 与铜元素同族,其基态原子价电子排布式
与铜元素同族,其基态原子价电子排布式_______ 。
(2)氧族元素有氧、硫、硒、碲等元素。 的
的 模型为
模型为_______ , 中碲的杂化轨道类型是
中碲的杂化轨道类型是_______ 。
(3)高氧化态 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,
的过氧化物的结构特点, 该配合物含有
该配合物含有_______  配位键(
配位键( 与O、N均形成了配位键);该结构中
与O、N均形成了配位键);该结构中 键角
键角_______ 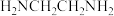 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(4) 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点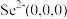 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点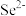 最远的
最远的 的位置
的位置_______ (用分数坐标表示),晶胞中距离最近的两个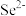 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度_______  。
。

 纳米片。回答下列问题:
纳米片。回答下列问题:(1)基态硫原子核外有
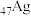 与铜元素同族,其基态原子价电子排布式
与铜元素同族,其基态原子价电子排布式(2)氧族元素有氧、硫、硒、碲等元素。
 的
的 模型为
模型为 中碲的杂化轨道类型是
中碲的杂化轨道类型是(3)高氧化态
 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,
的过氧化物的结构特点, 该配合物含有
该配合物含有 配位键(
配位键( 与O、N均形成了配位键);该结构中
与O、N均形成了配位键);该结构中 键角
键角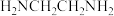 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(4)
 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点 最远的
最远的 的位置
的位置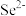 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度 。
。
您最近一年使用:0次
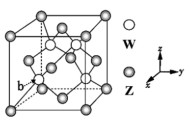
9 . X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素,Z元素原子的最外层电子数比次外层电子数少2,W的内层电子已全充满,最外层只有2个电子。请回答下列问题:
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___ ;该物质易溶于水的主要原因是___ 。
(2)元素Z的最高价氧化物中,Z原子的杂化方式是___ ,分子的空间构型是___ 。
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为___ 。原子的分数坐标,即将晶胞参数均看做“1”所得出的三维空间坐标,则晶胞中b原子的分数坐标为___ 。
(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___ 。
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是
(2)元素Z的最高价氧化物中,Z原子的杂化方式是
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为

(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为
您最近一年使用:0次
解题方法
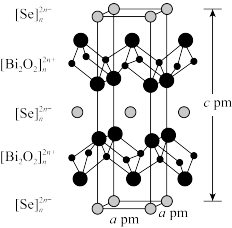
10 . 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:
(1)基态硒原子的价电子排布式为_______ ;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于_______ 晶体。
(2)O、P、S三种元素中,电负性最大的是_______ ;键角:H2O_______ H2Se(填">"、"<"或"=")。
(3)纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是_______ ;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。

由此可以推知纯磷酸液体中存在的导电微粒是 和
和_______ , 的空间构型为
的空间构型为_______ 。
(4)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的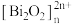 层与带负电的
层与带负电的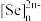 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为_______ ,其中Se的分数坐标为_______ 。晶胞棱边夹角均为90°,硒氧化铋的摩尔质量为 M g·mol-1,则晶体密度的表达式为_______ g·cm-3(NA为阿伏加德罗常数的值)。
(1)基态硒原子的价电子排布式为
(2)O、P、S三种元素中,电负性最大的是
(3)纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是

由此可以推知纯磷酸液体中存在的导电微粒是
 和
和 的空间构型为
的空间构型为(4)硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
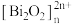 层与带负电的
层与带负电的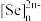 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为
您最近一年使用:0次
2021-03-11更新
|
686次组卷
|
4卷引用:山东省临沂市2021届高三第一次模拟考试化学试题
山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)重点11 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】



