名校
解题方法
1 . 根据所学内容填空:
(1)有下列物质:①HF、②Cl2、③H2O、④CCl4、⑤BF3、⑥CO2,其中属于极性分子的是_______ (填序号,下同),既有 键又有
键又有 键的是
键的是_______ 。
(2)下列分子中,空间构型为正四面体且键角为 的是
的是_______ 。
a. b.
b. c.
c.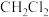 d.
d. e.
e. f.
f.
(3)H2O、 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是____ 。
(4)丙烯晴分子( )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为_______ 。
(5)VIA族元素氧、硫、硒( )的化合物在研究和生产中有许多重要用途。
)的化合物在研究和生产中有许多重要用途。
① 离子的空间构型为
离子的空间构型为_______ 。
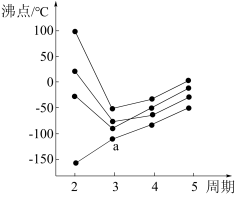
②如图所示,每条折线表示周期表IVA—VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ (化学式)
(1)有下列物质:①HF、②Cl2、③H2O、④CCl4、⑤BF3、⑥CO2,其中属于极性分子的是
 键又有
键又有 键的是
键的是(2)下列分子中,空间构型为正四面体且键角为
 的是
的是a.
 b.
b. c.
c.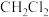 d.
d. e.
e. f.
f.
(3)H2O、
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(4)丙烯晴分子(
 )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为(5)VIA族元素氧、硫、硒(
 )的化合物在研究和生产中有许多重要用途。
)的化合物在研究和生产中有许多重要用途。①
 离子的空间构型为
离子的空间构型为②如图所示,每条折线表示周期表IVA—VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

您最近一年使用:0次
名校
解题方法
2 . 铜是生活中一种非常重要的金属,黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时涉及反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)O的轨道表示式为_______ ,其最高能级的原子轨道形状为_______ ,第一电离能:O_____ N(填“>”或“<”),Fe2+的价层电子排布式为______ 。
(2)SO2的VSEPR构型为_______ ,键角_______ H2O(填“>”或“<”);Cu元素位于周期表的________ 区,Cu和Zn的部分电离能数据如表所示,观察数据可知I2(Cu)>I2(Zn),对此,你的解释是______ 。
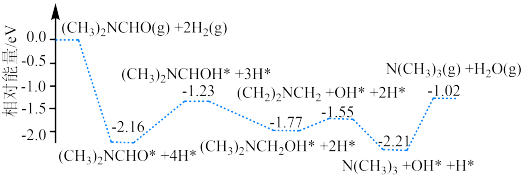
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:______ ;该反应在______ (填“高温”/“低温”/“任何温度”)下有自发性。
(1)O的轨道表示式为
(2)SO2的VSEPR构型为
| 元素 | Cu | Zn | |
| 电离能/(kJ•mol-1) | I1 | 746 | 906 |
| I2 | 1985 | 1733 | |
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:
您最近一年使用:0次
2024-03-10更新
|
127次组卷
|
2卷引用:四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
解题方法
3 . 已知周期表前四周期的元素a、b、c、d、e、f原子序数依次增大。a的核外电子总数与其周期数相同,c原子的最外层电子数是内层电子数的3倍,b、c左右相邻,c与d同族,e元素正三价离子的3d能级为半充满,f原子的次外层全充满,最外层只有一个电子。请回答下列问题:
(1)元素e的原子核外共有______ 种不同运动状态的电子,有_____ 种不同能级的电子。
(2)实验室中制备ba3的化学方程式为____ ,产生的ba3与a2d比较,键角更大的是____ ,原因是_____ 。
(3)f晶胞为面心立方最密堆积,其空间利用率为________ ,由d、e、f组成的物质晶胞结构如图。

①该物质的化学式为___________ 。
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为___________ ,与其互为等电子体的阴离子有___________ 。
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式___________ 。
(1)元素e的原子核外共有
(2)实验室中制备ba3的化学方程式为
(3)f晶胞为面心立方最密堆积,其空间利用率为

①该物质的化学式为
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式
您最近一年使用:0次



