名校
1 . 根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________ 的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________ 个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____ (填序号),易溶于水的有_____ (填序号),理由是:____________ 。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________ ,说明N2中________ 键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________ 、____________ 。
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
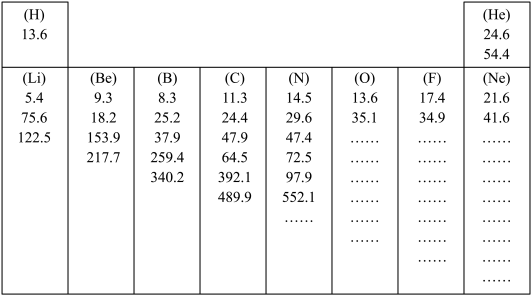
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( )
| A.NH3、BF3、CCl4中只有BF3是缺电子化合物 |
| B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3 |
| C.BF3与NH3反应时有配位键生成 |
| D.CCl4的键角小于NH3 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法中正确的是
| A.气体单质中,一定有σ键,可能有π键 |
| B.PCl3分子是非极性分子 |
| C.氢键键长一般定义为H…B的长度,而不是A-H…B的长度 |
D. 的VSEPR模型与离子的空间立体构型一致 的VSEPR模型与离子的空间立体构型一致 |
您最近一年使用:0次
2020-10-29更新
|
153次组卷
|
4卷引用:四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题
四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题四川省内江市威远中学2020-2021学年高二上学期期中考试化学试题(已下线)练习15分子的结构与物质的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)黑龙江省实验中学2023-2024学年高二下学期4月考化学试题
名校
4 . 下列说法不正确的是
| A.不是所有的共价键(σ键)都具有方向性 |
| B.N≡N的键能比N=N与N—N的键能和大,所以N≡N不易发生加成反应 |
| C.根据电负性及价层电子对互斥理论可知,OF2分子的构型与H2O分子的构型相同 |
| D.基态Na原子核外电子占有3个能层、4个能级、6个原子轨道,有6种运动状态不同的电子 |
您最近一年使用:0次
2021-02-08更新
|
200次组卷
|
3卷引用:四川省绵阳市江油中学2020-2021学年高二上学期期中考试化学试题
四川省绵阳市江油中学2020-2021学年高二上学期期中考试化学试题(已下线)2.2 分子的空间结构(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)专题4 分子空间结构与物质性质 本专题复习提升
名校
解题方法
5 . 从结构角度分析,下列说法错误的是
A.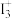 的立体构型为V形,中心原子的杂化方式为sp3 的立体构型为V形,中心原子的杂化方式为sp3 |
| B.ZnCO3中,阴离子立体构型为平面三角形,C原子的杂化方式为sp2 |
| C.因HF分子间存在氢键,所以HX中其沸点最高 |
| D.二氧化硅中硅,氧原子都是为sp3杂化,是极性分子 |
您最近一年使用:0次
2020-10-29更新
|
298次组卷
|
3卷引用:四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
6 . 下列说法中不正确的是
| A.葡萄糖分子(HOCH2−CHOH−CHOH−CHOH−CHOH−CHO)中的手性碳原子数为4 |
B.基态铜原子的价电子排布图: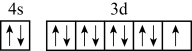 |
| C.[Co(NH3)4Cl2]+的中心离子配位数为6 |
| D.AB2是V形,其A可能为sp2杂化 |
您最近一年使用:0次
名校
解题方法
7 .  、
、 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是
 、
、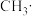 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是A.碳原子均采取sp2杂化,且 中所有原子均共面 中所有原子均共面 |
B.CH 与NH3、H3O+互为等电子体,几何构型均为三角锥形 与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
C. 与OH-形成离子化合物 与OH-形成离子化合物 |
D.两个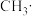 或一个 或一个 和一个 和一个 结合可得到不同化合物 结合可得到不同化合物 |
您最近一年使用:0次
2021-03-18更新
|
1775次组卷
|
8卷引用:青海省湟川中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
8 . X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期,X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1,下列说法不正确的是
| A.CX2(C是原子核内含6个质子的元素)分子是非极性分子 |
| B.ZH3的VSEPR模型名称为三角锥形 |
| C.Z4分子是非极性分子 |
| D.酸H2YO4比酸H3ZO4的酸性强 |
您最近一年使用:0次
2020-02-12更新
|
347次组卷
|
5卷引用:2020届高三化学二轮物质结构题型专攻——分子的性质【选择基础专练】
2020届高三化学二轮物质结构题型专攻——分子的性质【选择基础专练】四川省宜宾市叙州区第二中学校2019-2020学年高二下学期期中考试化学试题(已下线)第31讲 分子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)吉林省吉林市第一中学2022-2023学年高二上学期期末测试化学试题
名校
解题方法
9 . (1)基态溴原子的价层电子轨道排布式为________ ,第四周期中,与溴原子未成对电子数相同的金属元素有 ______ 种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有_________ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)OF2分子中,O的杂化类型为______ ,与下列微粒的中心原子杂化方式相同且空间构型也与OF2相同的是_______ (填字母), OF2分子VSEPR模型的名称为__________
A.PCl3 B.SO3 C. NH2- D.NO3-
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是_____________________________________________ 。
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_______ 。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。其晶胞与金刚石相似,其中B原子处于晶胞体内,P原子处于晶胞表面。
①磷化硼晶体属于_____ 晶体(填晶体类型),_____ (填“是”或“否”)含有配位键。
③已知BP的晶胞中最近的B与P原子核间距为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度表达式为________________ g·cm-3(用含a、NA的式子表示)。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)OF2分子中,O的杂化类型为
A.PCl3 B.SO3 C. NH2- D.NO3-
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。其晶胞与金刚石相似,其中B原子处于晶胞体内,P原子处于晶胞表面。
①磷化硼晶体属于
③已知BP的晶胞中最近的B与P原子核间距为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度表达式为
您最近一年使用:0次
名校
10 . 在气相中,关于BeF2和SF2的说法错误的是( )
| A.BeF2分子中,中心原子Be的价层电子对数等于2,成键电子对数也等于2 |
| B.SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤电子对 |
| C.BeF2分子的空间构型为直线形 |
| D.在气相中,BeF2是直线形而SF2是V形 |
您最近一年使用:0次
2019-06-23更新
|
79次组卷
|
6卷引用:2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A



