1 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)电负性P_______ As(填“>”或“<”或“=”)。
(2)尿素(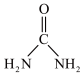 )中碳原子杂化类型
)中碳原子杂化类型_______ ; 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为_______ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是_______ 。
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。_______ ,As与Ga之间存在的化学键有_______ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为_______ 。晶胞密度为dg∙cm-3,摩尔质量为Mg∙mol-1 ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为_______ nm(列式表示)。
(1)电负性P
(2)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。
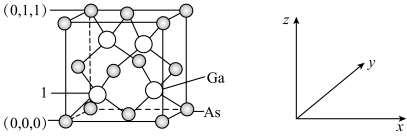
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为
您最近一年使用:0次
解题方法
2 . ⅡB-ⅥA化合物半导体纳米材料(如 、
、 、
、 、
、 )等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:
)等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:
(1)砷元素基态原子价层电子排布式为:___________
(2)下列状态的锌,分别失去最外层一个电子所需能量最小的是___________ 。
A. B.
B.
C. D.
D.
(3)雄黄( )如图1和雌黄(
)如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中
)如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为
原子轨道杂化类型为___________ 。图2中 键角
键角___________  键角(填
键角(填 ,
, 或
或 )。
)。

(4) 分子中
分子中 键数目有
键数目有___________ 个,分子的空间构型为___________ 。分子中大 键可用符号
键可用符号 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大 键原子数,n代表参与形成大
键原子数,n代表参与形成大 键电子数(如苯分子中的
键电子数(如苯分子中的 键可表示为
键可表示为 ,则
,则 中大
中大 键应表示为
键应表示为___________ 。
(5) 具有独特的电学及光学特性,是一种应用广泛的功能材料。
具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知 和O的电负性分别为1.65、3.5,
和O的电负性分别为1.65、3.5, 中化学键类型为
中化学键类型为___________ , 可以与
可以与 溶液溶解生成
溶液溶解生成 ,请从化学键角度解释能形成该离子的原因
,请从化学键角度解释能形成该离子的原因___________ 。
②一种 晶体的晶胞(立方体)如图3所示,
晶体的晶胞(立方体)如图3所示, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 原子半径为
原子半径为 。图4是沿着立方格子对角面取得的截图,则
。图4是沿着立方格子对角面取得的截图,则 原子与O原子间最短距离x=
原子与O原子间最短距离x=___________  。晶体的密度为
。晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。

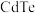 、
、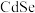 、
、 、
、 )等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:
)等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:(1)砷元素基态原子价层电子排布式为:
(2)下列状态的锌,分别失去最外层一个电子所需能量最小的是
A.
 B.
B.
C.
 D.
D.
(3)雄黄(
 )如图1和雌黄(
)如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中
)如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为
原子轨道杂化类型为 键角
键角 键角(填
键角(填 ,
, 或
或 )。
)。
(4)
 分子中
分子中 键数目有
键数目有 键可用符号
键可用符号 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大 键原子数,n代表参与形成大
键原子数,n代表参与形成大 键电子数(如苯分子中的
键电子数(如苯分子中的 键可表示为
键可表示为 ,则
,则 中大
中大 键应表示为
键应表示为(5)
 具有独特的电学及光学特性,是一种应用广泛的功能材料。
具有独特的电学及光学特性,是一种应用广泛的功能材料。①已知
 和O的电负性分别为1.65、3.5,
和O的电负性分别为1.65、3.5, 中化学键类型为
中化学键类型为 可以与
可以与 溶液溶解生成
溶液溶解生成 ,请从化学键角度解释能形成该离子的原因
,请从化学键角度解释能形成该离子的原因②一种
 晶体的晶胞(立方体)如图3所示,
晶体的晶胞(立方体)如图3所示, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 原子半径为
原子半径为 。图4是沿着立方格子对角面取得的截图,则
。图4是沿着立方格子对角面取得的截图,则 原子与O原子间最短距离x=
原子与O原子间最短距离x= 。晶体的密度为
。晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
3 . Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________ 。
(2)配合物K4Fe(CN)6的中心离子是____________ ,该离子价电子的基态电子排布图为____________ 。
(3)lmol HCN分子中含有σ键的数目为____________ ,HCN分子中碳原子轨道杂化类型是____________ ,与CN-互为等电子体的阴离子是____________ 。
(4)K2CO3中阴离子的空间构型为____________ ,其中碳原子的价层电子对数为____________ 。
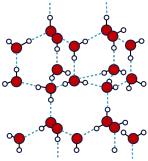
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________ 个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________ (用NA表示阿伏加德罗常数的值)。
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为
(2)配合物K4Fe(CN)6的中心离子是
(3)lmol HCN分子中含有σ键的数目为
(4)K2CO3中阴离子的空间构型为
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有

您最近一年使用:0次
2017-05-07更新
|
498次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题



