名校
解题方法
1 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________ 。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为___________ ,C、H、N的电负性由大到小的顺序为___________ 。
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是___________ 。___________ pm(列出计算式)。
(1)基态Ti原子的价电子轨道表示式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是

您最近一年使用:0次
名校
解题方法
2 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
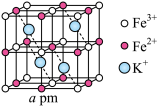
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为  )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
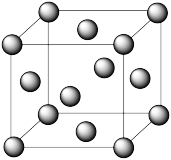
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近一年使用:0次
解题方法
4 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3)SO2分子的 VSEPR模型名称为_______
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
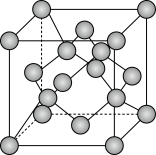
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为_______ cm。
(1)Cr的价电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)SO2分子的 VSEPR模型名称为
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为

您最近一年使用:0次



