1 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(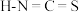 ),其原因是
),其原因是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(3)卤素互化物如 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为___________ 。
(4)请推测① 、②
、②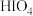 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________ (填序号)。
(5) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为___________ 个;若该晶胞的边长为 ,则该晶体的密度为
,则该晶体的密度为___________  (写出表达式)。
(写出表达式)。

(1)拟卤素
 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(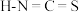 ),其原因是
),其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如
 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为(4)请推测①
 、②
、②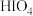 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为(5)
 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为 ,则该晶体的密度为
,则该晶体的密度为 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
解题方法
2 . 第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr原子价电子排布图___________ 。
(2)钒广泛用于催化及钢铁工业,被称之为“工业的味精”。 常用作
常用作 转化为
转化为 的催化剂。
的催化剂。 分子VSEPR模型是
分子VSEPR模型是___________ ; 气态为单分子,
气态为单分子, 的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为
的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________ ;该结构中S-O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为___________ (填图中字母a或者b)。

(3)镍是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物 ,其中配原子是C,原因是
,其中配原子是C,原因是___________ 。
(4)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(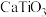 )晶体是工业获取钛的重要原料。
)晶体是工业获取钛的重要原料。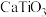 晶胞如图,晶胞参数为a nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为
晶胞如图,晶胞参数为a nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________ nm,与Ti紧邻的O个数为___________ 。

(5)在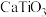 晶胞结构的另一种表示形式中,Ti处于体心位置,则Ca处于
晶胞结构的另一种表示形式中,Ti处于体心位置,则Ca处于___________ 位置,O处于___________ 位置。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr原子价电子排布图
(2)钒广泛用于催化及钢铁工业,被称之为“工业的味精”。
 常用作
常用作 转化为
转化为 的催化剂。
的催化剂。 分子VSEPR模型是
分子VSEPR模型是 气态为单分子,
气态为单分子, 的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为
的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为
(3)镍是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物
 ,其中配原子是C,原因是
,其中配原子是C,原因是(4)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(
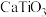 )晶体是工业获取钛的重要原料。
)晶体是工业获取钛的重要原料。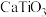 晶胞如图,晶胞参数为a nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为
晶胞如图,晶胞参数为a nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为
(5)在
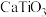 晶胞结构的另一种表示形式中,Ti处于体心位置,则Ca处于
晶胞结构的另一种表示形式中,Ti处于体心位置,则Ca处于
您最近一年使用:0次
解题方法
3 . 胆矾(CuSO4·5H2O)可用于泳池杀菌消毒。回答下列问题:
(1)铜元素位于元素周期表的_____ 区,基态Cu原子的核外电子排布式为_____ 。
(2)CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图:
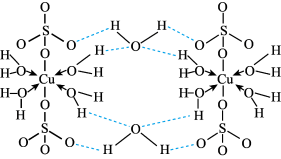
① 的空间构型为
的空间构型为_____ ,其中硫原子的杂化方式为_____ 。
②硫酸铜晶体中Cu2+的配位数为_____ ,[Cu(H2O)4]2+中配位原子是_____ 。
③在上述结构示意图中,存在的化学键有_____ 。
(3)向CuSO4溶液中逐滴加入氨水,溶液最终变为深蓝色,原因是_____ 。
(1)铜元素位于元素周期表的
(2)CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图:

①
 的空间构型为
的空间构型为②硫酸铜晶体中Cu2+的配位数为
③在上述结构示意图中,存在的化学键有
(3)向CuSO4溶液中逐滴加入氨水,溶液最终变为深蓝色,原因是
您最近一年使用:0次
2023-04-06更新
|
180次组卷
|
2卷引用:湖北省宜昌市协作体2022-2023学年高二下学期期中考试化学试题
名校
解题方法
4 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
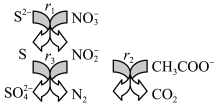
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
579次组卷
|
4卷引用:湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题
名校
解题方法
5 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为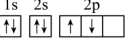 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 _______ 。
(2)B元素的电负性_______ (填“大于”“小于”或“等于”)C元素的电负性。B元素的第一电离能 _______ (填“大于”“小于”或“等于”)C元素的第一电离能。
(3)AC 的空间结构为
的空间结构为 _______ ,中心原子的杂化轨道类型为 _______ 。
(4)E原子中电子占据的最高能层符号是_______ ,该能层具有的原子轨道数为 _______ 。
(5)F元素位于元素周期表中的_______ 区,F2+的价层电子轨道表达式为 _______ 。
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为_______ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ•mol﹣1;I2=1451kJ•mol﹣1;I2=7733kJ•mol﹣1;I4=10540kJ•mol﹣1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 (2)B元素的电负性
(3)AC
 的空间结构为
的空间结构为 (4)E原子中电子占据的最高能层符号是
(5)F元素位于元素周期表中的
(6)过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 物质的结构决定物质的性质。请回答下列问题:
(1)下列有关物质结构与性质的说法中错误的有_______ (填标号)。
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
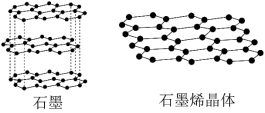
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是_______ ,12g石墨烯中由碳原子连接成的六元环的物质的量约为_______ mol。
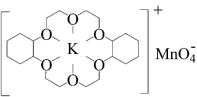
(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是_______ 。
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是_______ 。
KMnO4+

(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
(5)硅的含氧化合物都以硅氧四面体(SiO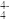 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为_______ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为_______ 。
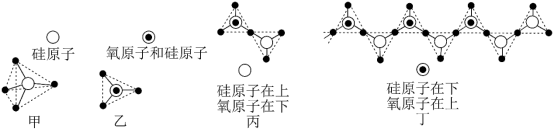
(1)下列有关物质结构与性质的说法中错误的有
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是

(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是
KMnO4+



(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
| A.苯 | B.三氧化硫 | C.四氯化碳 | D.环己烷 |
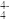 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
您最近一年使用:0次
7 . 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及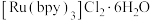 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。
(1)下列有关Ni原子的叙述正确的是___________(填标号)。
(2)三乙醇胺的制备:3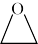 +NH3
+NH3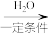 N(CH2CH2OH)3
N(CH2CH2OH)3
①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为___________ 。
②下列关于 和
和 的叙述正确的是
的叙述正确的是___________ 。
A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D. 分子的键角比
分子的键角比 分子的键角大
分子的键角大
(3)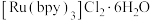 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为___________ ,则1mol配体bpy分子中含有σ键的数目为___________ 。与bpy分子有相似结构的单环分子吡啶的结构简式为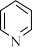 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为___________ (用 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。
(4)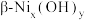 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g/cm3(列出表达式)。
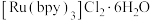 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。(1)下列有关Ni原子的叙述正确的是___________(填标号)。
| A.第一电离能比钙的大 |
B.基态Ni原子的核外价电子排布式为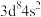 |
C.基态Ni原子形成基态 时,先失去3d轨道上的电子 时,先失去3d轨道上的电子 |
| D.基态Co原子第五电离能比基态Ni原子第五电离能大 |
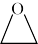 +NH3
+NH3 N(CH2CH2OH)3
N(CH2CH2OH)3①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为
②下列关于
 和
和 的叙述正确的是
的叙述正确的是A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D.
 分子的键角比
分子的键角比 分子的键角大
分子的键角大(3)
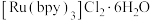 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为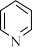 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。(4)
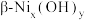 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
2022-03-14更新
|
465次组卷
|
3卷引用:湖北省重点高中智学联盟2021-2022学年高二下学期3月联考化学试题
解题方法
8 . 前四周期元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是_______ 。
a. b.
b. c.
c. d.
d.
(2)基态铜原子的价电子排布式为_______ 。
(3) 的几何构型为
的几何构型为_______ ,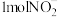 中含有的价层电子对数目为
中含有的价层电子对数目为_______ 。
(4)已知下图均与第三周期的主族元素有关。
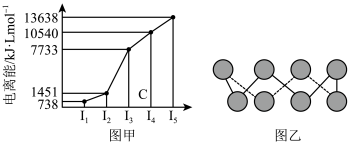
①图甲表示第一至第五电离能数据,则该元素的原子有_______ 种不同运动状态的电子。
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为_______ ,其易溶于 的原因是
的原因是_______ 。
(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是_______ 。

(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a.
 b.
b. c.
c.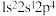 d.
d.
(2)基态铜原子的价电子排布式为
(3)
 的几何构型为
的几何构型为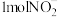 中含有的价层电子对数目为
中含有的价层电子对数目为(4)已知下图均与第三周期的主族元素有关。

①图甲表示第一至第五电离能数据,则该元素的原子有
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为
 的原因是
的原因是(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是

您最近一年使用:0次
名校
解题方法
9 . 推广磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺( )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。
回答下列问题:
(1)基态铁原子核外电子运动状态有______ 种;基态Fe3+较基态Fe2+稳定的原因是______ 。
(2)在NH4H2PO4中的N、P、O三种元素的电负性由大到小的顺序是______ ;NH 的空间构型为
的空间构型为______ ;H2PO 中P原子的杂化轨道类型为
中P原子的杂化轨道类型为______ 。
(3)1mol 中含有
中含有______ molσ键;苯胺水溶性大于苯的主要原因是______ 。
(4)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。

①石墨的硬度小、熔沸点高的原因分别是______ 。
②如图晶体的化学式为______ ;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为______ g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
 )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。回答下列问题:
(1)基态铁原子核外电子运动状态有
(2)在NH4H2PO4中的N、P、O三种元素的电负性由大到小的顺序是
 的空间构型为
的空间构型为 中P原子的杂化轨道类型为
中P原子的杂化轨道类型为(3)1mol
 中含有
中含有(4)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。

①石墨的硬度小、熔沸点高的原因分别是
②如图晶体的化学式为
您最近一年使用:0次
2021-12-30更新
|
1453次组卷
|
6卷引用:湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题
湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题四川省成都市2021-2022学年高三上学期第一次诊断性检测理综化学试题(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)宁夏回族自治区石嘴山市平罗中学2022届高三第三次模拟理科综合化学试题
11-12高二上·湖北黄冈·期中
解题方法
10 . 已知硼酸(分子式为H3BO3)对人体的受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)已知硼酸分子中H只与O成键,则其分子结构式为____________ ,由其结构可推知硼酸应属于______ 酸(选填“弱”或“强”)。
(2)已知硼酸晶体呈片状,具有类似石墨那样的片层结构,片层之间作用较弱,有滑腻感,可做润滑剂。则层内H3BO3分子之间的作用力是________ ,层与层间的作用力是______ 。
(3)已知0.01mol硼酸可以被20mL 0.5mol·L-1NaOH溶液恰好完全中和,据此推知硼酸属____ 元酸。研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层有达到8电子稳定结构的趋向,如 。写出硼酸与NaOH溶液反应的离子方程式:
。写出硼酸与NaOH溶液反应的离子方程式:____________ 。
(1)已知硼酸分子中H只与O成键,则其分子结构式为
(2)已知硼酸晶体呈片状,具有类似石墨那样的片层结构,片层之间作用较弱,有滑腻感,可做润滑剂。则层内H3BO3分子之间的作用力是
(3)已知0.01mol硼酸可以被20mL 0.5mol·L-1NaOH溶液恰好完全中和,据此推知硼酸属
 。写出硼酸与NaOH溶液反应的离子方程式:
。写出硼酸与NaOH溶液反应的离子方程式:
您最近一年使用:0次



