解题方法
1 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W的核外电子只有一种自旋方向;Y、Z、R在元素周期表中相邻,X的核外电子数与Y的价层电子数相等,R2是氧化性最强的单质,回答下列问题:
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是___________ (填标号)。
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3___________ XR3(填“>”或“<”或“=”);YR3与YW3结构相似,YW3易与过渡金属阳离子形成配离子而YR3不能,原因是___________ 。
(3)同周期元素中,第一电离能比Z大的元素有_________ 种;Z与Y形成的固态Y2Z5由YZ 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为_________ ,YZ 的电子式为
的电子式为_________ 。
(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=___________ ,该阴离子的结构式为___________ 。
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3
(3)同周期元素中,第一电离能比Z大的元素有
 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为 的电子式为
的电子式为(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z
 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=
您最近一年使用:0次
解题方法
2 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
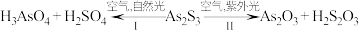
下列说法错误的是
 )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应: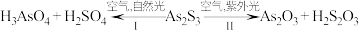
下列说法错误的是
A. 和 和 的空间构型都是正四面体形 的空间构型都是正四面体形 |
| B.反应Ⅰ和Ⅱ中均有两种氧化产物 |
C.反应Ⅰ和Ⅱ中,氧化1  转移的电子数之比为7∶3 转移的电子数之比为7∶3 |
D.反应Ⅰ和Ⅱ中,参加反应 的比值:反应Ⅰ 的比值:反应Ⅰ 反应Ⅱ 反应Ⅱ |
您最近一年使用:0次
名校
解题方法
3 . LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。请回答:
(1)PO 的立体构型是
的立体构型是_____ ,Fe2+的价层电子轨道表示式是_____ 。
(2)题干中所给四种物质所含的非金属元素中,电负性最大的是_____ ,基态原子第一电离能最小的是_____ 。
(3)抗坏血酸( )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是_____ 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生_____ (填“物理”或“化学”)变化。
②相同条件,Li+在_____ (选填“LiPF6”或“LiAsF6”)中迁移较快。
③图乙中X的杂化方式最可能是_____ (填字母编号)。
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为_____ 。
②图中A、B两原子核间距离为_____ nm(只列计算式)。
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是_____ (填字母)。
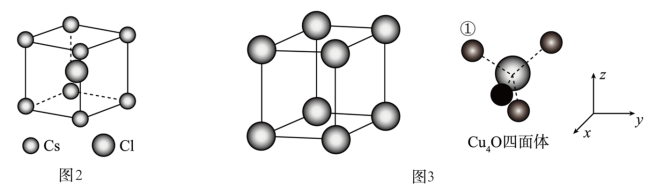
(7)Cu2O晶体结构与CsCl(图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有_____ 个“Cu2O”;Cu2O晶胞中Cu的配位数是_____ ;若①处Cu原子坐标为( ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为_____ 。
(1)PO
 的立体构型是
的立体构型是(2)题干中所给四种物质所含的非金属元素中,电负性最大的是
(3)抗坏血酸(
 )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
③图乙中X的杂化方式最可能是
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为
②图中A、B两原子核间距离为
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为
您最近一年使用:0次
4 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、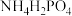 、LiCl及苯胺(
、LiCl及苯胺(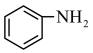 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
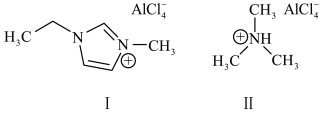
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
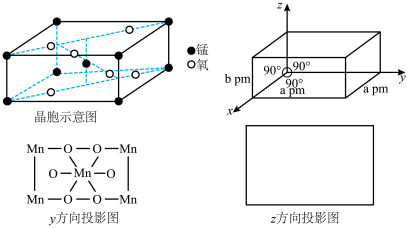
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、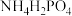 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
名校
解题方法
5 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
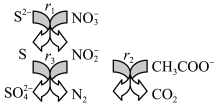
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
579次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
名校
解题方法
6 . X、Y、Z、W、Q五种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为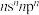 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
(1)W核外电子空间运动状态共有_______ 种。
(2)阴离子 、
、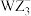 的空间构型分别是
的空间构型分别是_______ 、_______ 。
(3)基态Q原子中,核外电子占据最高能层的符号是_______ ,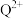 的价电子排布式为
的价电子排布式为_______ ,Q在周期表中的位置是_______ 区。
(4) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(5)Y与W可形成化合物YW3。资料显示:Y元素电负性略大于W;YW3可溶于水发生水解反应。试判断YW3可能的水解产物为_______ (写化学式)。
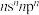 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。(1)W核外电子空间运动状态共有
(2)阴离子
 、
、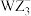 的空间构型分别是
的空间构型分别是(3)基态Q原子中,核外电子占据最高能层的符号是
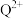 的价电子排布式为
的价电子排布式为(4)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为(5)Y与W可形成化合物YW3。资料显示:Y元素电负性略大于W;YW3可溶于水发生水解反应。试判断YW3可能的水解产物为
您最近一年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
7 . 下列说法错误的是
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
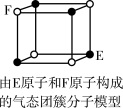
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题
解题方法
8 . X、Y、Z、W、M、N、R是原子序数依次增大的前四周期元素,基态M原子的电子填充了3个能级,其中有2个未成对电子,N的最高正价与最低负价的代数和为6,基态R2+的d轨道半充满。由上述元素中的五种组成的某多孔储氢材料前驱体结构如图所示。

回答下列问题:
(1)基态Y原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形;第一电离能介于Y和M之间的同周期元素有_______ 种。
(2)键角比较:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,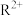 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为_______ ;该配合物中心原子的价层电子对数为_______ ;下列对该配合物中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.

回答下列问题:
(1)基态Y原子的价电子排布图为
(2)键角比较:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,
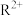 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-09-05更新
|
383次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题
名校
解题方法
9 . 金属元素Mg、Al、Ti、Fe、Cu等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是____ ,H、B、Ti的电负性由小到大的顺序为____ 。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用—
表示,与之相反的用— 表示,
表示,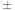
 即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为____ 。
(3)Cu(NO3)2是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则Cu2+的杂化轨道类型为____ (填标号)。
A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是____ (填化学式),此时生成的配离子溶液的颜色为____ 色。

(4)已知Mg、A1、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中A13+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。

该物质的化学式为____ ,Mg2+的配位数为____ ,两个Mg2+之间最近的距离是____ pm。
(1)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用—
表示,与之相反的用— 表示,
表示,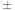
 即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为(3)Cu(NO3)2是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则Cu2+的杂化轨道类型为
A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是

(4)已知Mg、A1、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中A13+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。

该物质的化学式为
您最近一年使用:0次
2022-05-24更新
|
805次组卷
|
4卷引用:山东省济宁市2022届高三下学期第三次模拟考试化学试题
山东省济宁市2022届高三下学期第三次模拟考试化学试题(已下线)2022年山东省高考真题变式题(非选择题)四川省成都市第七中学2022-2023学年高二上学期期末质量检测化学试题四川省成都市第七中学2022-2023学年高二上学期期末考试化学试卷
名校
解题方法
10 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
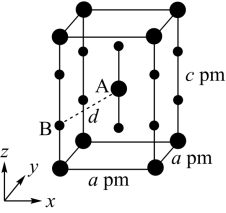
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
860次组卷
|
7卷引用:山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题



