名校
解题方法
1 . 合成氨是人类科学技术上的一项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源。
①氮原子的价电子轨道表示式为___________ 。
②自然固氮过程中生成的 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是_______ 。
②下列比较正确的是_______ 。
A.第一电离能Al>Mg>Na B.熔点:MgO>CaO
C.离子半径: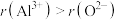 D.键角:H2O>NH3
D.键角:H2O>NH3
③ⅤA族元素的气态氢化物中NH3沸点最高的原因是_______ 。
④ 中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是_______ 、_______ 。

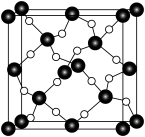
(3)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。该晶体密度为___________  (写出表达式)。(底边长为anm,高为cnm,设阿伏加德罗常数的值为
(写出表达式)。(底边长为anm,高为cnm,设阿伏加德罗常数的值为 ,
, )
)

(1)自然界中的氮元素主要以分子的形式存在于空气中,是固氮的主要来源。
①氮原子的价电子轨道表示式为
②自然固氮过程中生成的
 的VSEPR模型名称为
的VSEPR模型名称为(2)铁触媒是普遍使用的人工合成氨的催化剂,以铁为主体通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②下列比较正确的是
A.第一电离能Al>Mg>Na B.熔点:MgO>CaO
C.离子半径:
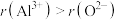 D.键角:H2O>NH3
D.键角:H2O>NH3③ⅤA族元素的气态氢化物中NH3沸点最高的原因是
④
 中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示,则甲、乙对应的分子分别是
(3)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 (写出表达式)。(底边长为anm,高为cnm,设阿伏加德罗常数的值为
(写出表达式)。(底边长为anm,高为cnm,设阿伏加德罗常数的值为 ,
, )
)
您最近一年使用:0次
解题方法
2 . 葡萄糖酸锌是一种常用的补锌剂,可由葡萄糖酸钙与硫酸锌直接反应制得: 。
。
回答下列问题:
(1)基态 核外电子排布式为
核外电子排布式为___________ 。
(2) 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为___________ 键,其电子对由___________ (填元素符号)提供。
(3) 的空间构型为
的空间构型为___________ ,写出一种与其互为等电子体的分子:___________ (填化学式)。
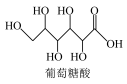
(4)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为___________ ,葡萄糖酸易溶于水的主要原因是___________ ; 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为___________ 。
(5)用ZnS可以制备 ,ZnS的立方晶胞如图所示,晶胞参数为apm,已知阿伏加德罗常数为
,ZnS的立方晶胞如图所示,晶胞参数为apm,已知阿伏加德罗常数为 ,ZnS晶体的密度为
,ZnS晶体的密度为___________  。
。

 。
。回答下列问题:
(1)基态
 核外电子排布式为
核外电子排布式为(2)
 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为(3)
 的空间构型为
的空间构型为(4)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为
(5)用ZnS可以制备
 ,ZnS的立方晶胞如图所示,晶胞参数为apm,已知阿伏加德罗常数为
,ZnS的立方晶胞如图所示,晶胞参数为apm,已知阿伏加德罗常数为 ,ZnS晶体的密度为
,ZnS晶体的密度为 。
。
您最近一年使用:0次
解题方法
3 . 含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为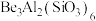 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________ 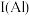 。
。
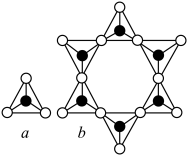
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ , 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
(5) 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角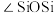 并不是
并不是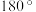 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
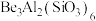 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
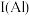 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
 |  | 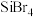 |  | |
| 沸点/K | 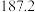 | 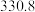 | 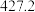 | 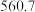 |
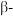 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为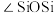 并不是
并不是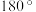 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
4 . 磷、氮和硫的相关化合物在药物化学及农业化学领域应用广泛。回答下列问题:
(1) 分子空间结构为
分子空间结构为___________ , 与
与 反应生成
反应生成 ,
, 结构为
结构为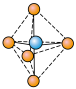 ,
, 是
是___________ (填“极性”或“非极性”)分子。
(2)氯吡苯脲是一种常用的膨大剂,其结构简式为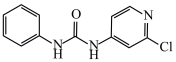 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
①氯吡苯脲分子___________ (填“是”或“不是”)手性分子。
②氯吡苯脲分子中存在的作用力包括___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D. 键 E.配位键
键 E.配位键
(3)胆矾 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
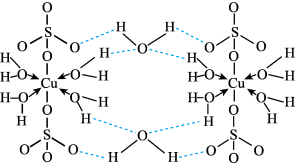
⑤该配合物的中心离子是___________ 。
②下列关于胆矾的说法正确的是___________ (填字母)。
A.基态 的价层电子排布式为
的价层电子排布式为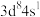
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
(1)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成 ,
, 结构为
结构为 ,
, 是
是(2)氯吡苯脲是一种常用的膨大剂,其结构简式为
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。①氯吡苯脲分子
②氯吡苯脲分子中存在的作用力包括
A.离子键 B.极性键 C.非极性键 D.
 键 E.配位键
键 E.配位键(3)胆矾
 可写成
可写成 ,其结构示意图如下:
,其结构示意图如下:
⑤该配合物的中心离子是
②下列关于胆矾的说法正确的是
A.基态
 的价层电子排布式为
的价层电子排布式为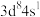
B.胆矾在不同温度下分步失去结晶水
C.根据结构图显示,胆矾在微观层次是平面结构
D.胆矾中的水分子间存在氢键
您最近一年使用:0次
2023-05-19更新
|
172次组卷
|
2卷引用:江西省赣州市第四中学2022-2023学年高二下学期6月期末化学试题
名校
解题方法
5 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
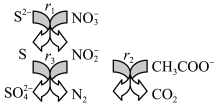
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
579次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
6 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
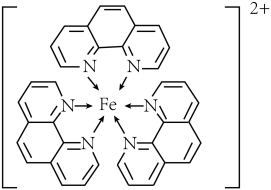
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
7 . 下列说法错误的是
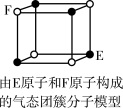
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:贵州省思南中学2018-2019学年高二下学期期末考试化学试题
解题方法
8 . X、Y、Z、W、M、N、R是原子序数依次增大的前四周期元素,基态M原子的电子填充了3个能级,其中有2个未成对电子,N的最高正价与最低负价的代数和为6,基态R2+的d轨道半充满。由上述元素中的五种组成的某多孔储氢材料前驱体结构如图所示。

回答下列问题:
(1)基态Y原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形;第一电离能介于Y和M之间的同周期元素有_______ 种。
(2)键角比较:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中, 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为_______ ;该配合物中心原子的价层电子对数为_______ ;下列对该配合物中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.

回答下列问题:
(1)基态Y原子的价电子排布图为
(2)键角比较:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,
 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-09-05更新
|
382次组卷
|
2卷引用:山东省临沂市2021-2022学年高二下学期期末考试化学试题
9 . 在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的离子反应方程式: 。回答下列问题:
。回答下列问题:
(1)写出基态 的核外电子排布式:
的核外电子排布式:_______ 。
(2)配离子 中心原子的配位数为
中心原子的配位数为_______ ,配位原子为_______ 。
(3)经测定发现, 固体由
固体由 和
和 两种离子组成,
两种离子组成, 的空间构型为
的空间构型为_______ ;与 互为等电子体的分子有
互为等电子体的分子有_______ (写出一种)。
(4)石墨可作润滑剂,其主要原因是_______ 。
(5)一种金铜合金晶体具有面心立方最密堆积结构,其晶胞如图A所示。

①该晶体中金属原子之间的作用力为_______ 。
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 (如图B)的结构相似,该晶体储氢后的化学式为
(如图B)的结构相似,该晶体储氢后的化学式为_______ 。
③已知该合金密度为 ,铜的原子半径为127.8pm,阿伏加德罗常数值为NA,则Au原子半径r(Au)=
,铜的原子半径为127.8pm,阿伏加德罗常数值为NA,则Au原子半径r(Au)= _______ =pm(列出计算式)。
 。回答下列问题:
。回答下列问题:(1)写出基态
 的核外电子排布式:
的核外电子排布式:(2)配离子
 中心原子的配位数为
中心原子的配位数为(3)经测定发现,
 固体由
固体由 和
和 两种离子组成,
两种离子组成, 的空间构型为
的空间构型为 互为等电子体的分子有
互为等电子体的分子有(4)石墨可作润滑剂,其主要原因是
(5)一种金铜合金晶体具有面心立方最密堆积结构,其晶胞如图A所示。

①该晶体中金属原子之间的作用力为
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与
 (如图B)的结构相似,该晶体储氢后的化学式为
(如图B)的结构相似,该晶体储氢后的化学式为③已知该合金密度为
 ,铜的原子半径为127.8pm,阿伏加德罗常数值为NA,则Au原子半径r(Au)=
,铜的原子半径为127.8pm,阿伏加德罗常数值为NA,则Au原子半径r(Au)=
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题
(1)我国科学家发现了一类由Fe-Se-As-F-O组成的磁性超导材料。下列有关叙述正确的是___________(填字母序号)。
(2)在碱性溶液中, 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。

下列说法正确的是___________(填字母序号)
(3)新材料的研制与应用始终是科技发展的主要方向之一。
①某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是___________ 。
②硼及其化合物广泛应用于永磁材料、超导材料等领域,理可以与氧气反应生成 气体,
气体, 分子的立体构型为
分子的立体构型为___________ 。
③肼可用作火箭燃料,燃烧时发生的反应是:


若该反应中有4mol N-H键断裂,则形成的π键有___________ mol。 与
与 结构相似且相对分子质量接近,
结构相似且相对分子质量接近, 常温下为气体,而
常温下为气体,而 常温下为液体的原因是
常温下为液体的原因是___________ 。
④钛被誉为“21世纪的金属”。Ti的四卤化物熔点如下表所示: 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
⑤立方氮化硼的结构与金石相似(如图),硬度与金刚石相当,晶胞边长为a pm。立方氮化硼晶胞中含有___________ 个硼原子,已知氮的原子半径 ,则硼的原子半径
,则硼的原子半径
___________ pm(用含a、b的代数式表示)。

(1)我国科学家发现了一类由Fe-Se-As-F-O组成的磁性超导材料。下列有关叙述正确的是___________(填字母序号)。
A.Fe变成 时首先失去3d轨道电子 时首先失去3d轨道电子 | B.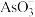 的空间构型为平面正三角形 的空间构型为平面正三角形 |
C.第一电离能: | D.基态F原子有9种运动状态的电子 |
 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。
下列说法正确的是___________(填字母序号)
| A.该配离子与水分子形成氢键的原子有N、O、H |
| B.该配离子中铜离子的配位数是2 |
C.该配离子中C原子的杂化方式均是 |
D.该配离子中非金属元素的电负性大小顺序为 |
①某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是
②硼及其化合物广泛应用于永磁材料、超导材料等领域,理可以与氧气反应生成
 气体,
气体, 分子的立体构型为
分子的立体构型为③肼可用作火箭燃料,燃烧时发生的反应是:


若该反应中有4mol N-H键断裂,则形成的π键有
 与
与 结构相似且相对分子质量接近,
结构相似且相对分子质量接近, 常温下为气体,而
常温下为气体,而 常温下为液体的原因是
常温下为液体的原因是④钛被誉为“21世纪的金属”。Ti的四卤化物熔点如下表所示:
 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是 |  |  |  | |
| 熔点/℃ | 377 | -24.1 | 38.3 | 155 |
 ,则硼的原子半径
,则硼的原子半径

您最近一年使用:0次



