名校
解题方法
1 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: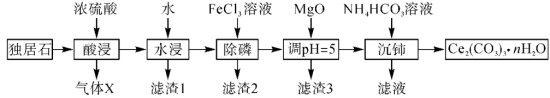
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
解题方法
2 . X、Y、Z、W、M、N、R是原子序数依次增大的前四周期元素,基态M原子的电子填充了3个能级,其中有2个未成对电子,N的最高正价与最低负价的代数和为6,基态R2+的d轨道半充满。由上述元素中的五种组成的某多孔储氢材料前驱体结构如图所示。

回答下列问题:
(1)基态Y原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形;第一电离能介于Y和M之间的同周期元素有_______ 种。
(2)键角比较:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中, 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为_______ ;该配合物中心原子的价层电子对数为_______ ;下列对该配合物中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.

回答下列问题:
(1)基态Y原子的价电子排布图为
(2)键角比较:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,
 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-09-05更新
|
383次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题
名校
解题方法
3 . 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________ 。
(2)C的氢化物分子是_____ (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是______ 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为__________ ;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式_______ 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为___________ 。

(1)A、B、C、D的第一电离能由小到大的顺序为
(2)C的氢化物分子是
(3)化合物BD3的分子空间构型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为

您最近一年使用:0次
2020-09-04更新
|
261次组卷
|
2卷引用:山东省济宁市微山县第二中学2021届高三上学期开学收心考试化学试题



