解题方法
1 . 第Ⅷ族元素铁、钴、镍性质相似,称为铁系元素。单质及其化合物在生命科学、工业生产等领域有着重要的应用。回答下列问题。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。

卟吩分子中N原子采取___________ 杂化,血红素中心离子的配位数为___________ ,血红素中含有的化学键有___________ (填序号)。
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
___________  。(列出算式)
。(列出算式)
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为___________ ;N所替代的O的位置可能是___________ 。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心
 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
卟吩分子中N原子采取
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为
 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
 。(列出算式)
。(列出算式)②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,
 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为
您最近一年使用:0次
2023-07-11更新
|
96次组卷
|
2卷引用:山西省吕梁市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
2 . 配离子 球棍模型如下图所示。下列关于该配离子的说法中不正确的是
球棍模型如下图所示。下列关于该配离子的说法中不正确的是

 球棍模型如下图所示。下列关于该配离子的说法中不正确的是
球棍模型如下图所示。下列关于该配离子的说法中不正确的是
| A.配位数为4 |
B. 中的 中的 采用 采用 杂化 杂化 |
C.配体是 , , 的空间构型为三角锥形 的空间构型为三角锥形 |
D.若用 代替 代替 与 与 形成配位键,则配位键的强度将减弱 形成配位键,则配位键的强度将减弱 |
您最近一年使用:0次
2023-07-11更新
|
161次组卷
|
3卷引用:山西省吕梁市2022-2023学年高二下学期期末考试化学试题
3 . 锂、铁、铬、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题。
(1)Fe在元素周期表中的位置为_______ ,位于_______ 区,有_______ 个不同运动状态的价电子,最高能层中电子所占据的原子轨道呈_______ 形。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.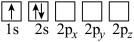 B.
B.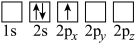
C. D.
D.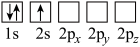
(5)①对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
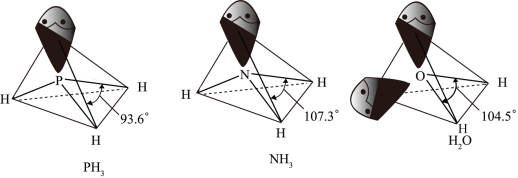
 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的分析原因:
的分析原因:_______ 。
(1)Fe在元素周期表中的位置为
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:N<O<F |
| D.元素的最高正价:C<N<O |
 形式,画出
形式,画出 的链状结构
的链状结构(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的分析原因:
的分析原因:
您最近一年使用:0次
4 . 三氟乙酸乙酯( )是制备某药物的原料,下列说法正确的是
)是制备某药物的原料,下列说法正确的是
 )是制备某药物的原料,下列说法正确的是
)是制备某药物的原料,下列说法正确的是| A.该分子中的碳原子只有一种杂化方式 |
| B.合成该分子所需的原料三氟乙酸的酸性大于乙酸 |
| C.1个该分子中含有12个σ键和2个π键 |
| D.该分子是极性分子,所以在水中的溶解度很大 |
您最近一年使用:0次
2023-01-15更新
|
199次组卷
|
2卷引用:山西省吕梁市孝义市2022-2023学年高二上学期期末考试化学试题
5 . 钛很多重要的化合物。如TiO2、TiCl4、[Ti(OH)2(H2O)4]Cl2。如图为TiO2催化下,O3降解CH3CHO的示意图。回答下列问题:

(1)基态Ti原子的价层电子排布式为________ 。
(2)1molCH3CHO中含有的σ键的数目为_________ (设阿伏加 德罗常数的值为NA),碳原子的杂化方式为________ 。
(3)乙醛的沸点_________ (填“高于”或“低于”)乙醇的沸点,原因是_________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序_________ 。
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为__________ 形。
③M中不含(填代号)________ 。
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是__________ 。
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于_________ 晶体。
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为________ 。已知晶体TiO2的晶胞如图2所示,其晶胞边长为540.0pm,密度为_________ g•cm-3(列式表示),Ti与O之间的距离为________ pm(列式表示)。


(1)基态Ti原子的价层电子排布式为
(2)1molCH3CHO中含有的σ键的数目为
(3)乙醛的沸点
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为
③M中不含(填代号)
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为

您最近一年使用:0次
2020-08-06更新
|
91次组卷
|
2卷引用:山西省孝义市2019-2020学年高二下学期期末考试化学试题
解题方法
6 . 元素X的基态原子的2p能级有4个电子;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。下列推断正确的是
A.Y是S元素,基态原子最外层电子排布图为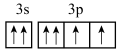 |
| B.离子晶体ZX、ZY的熔点:ZX>ZY |
| C.在Y的氢化物H2Y分子中,Y原子轨道的杂化类型是sp2 |
| D.Y与X可形成YX32-,立体构型为四面体 |
您最近一年使用:0次
2020-08-06更新
|
561次组卷
|
3卷引用:山西省孝义市2019-2020学年高二下学期期末考试化学试题
山西省孝义市2019-2020学年高二下学期期末考试化学试题山西省朔州市重点中学2019-2020学年高一下学期期末教学质量检测化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
2018·河北·一模
解题方法
7 . 氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中显示出良好的应用前景。回答下列问题:
(1)下列N原子电子排布图表示的状态中,能量最低和最高的分别为__________ 、__________ 。(填标号)
A.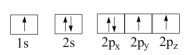 B.
B. 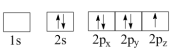
C.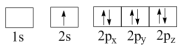 D.
D. 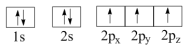
(2)N3-与Na+具有相同的电子构型,r(N3-)大于r(Na+),原因是____________________ 。
(3)Ca3(PO4)2在食品工业中用作抗结剂、营养增补剂,Ca3(PO4)2中的阴离子空间构型是__________ ,中心原子P的杂化形式为__________ 。Ca3(PO4)2中,存在__________ (填标号)。
A离子键 B.σ键 C.π键 D.氢键
(4)受民间中医启发,科研工作者发现As2O3(俗称砒霜,或写作As4O6)对白血病有明显的治疗作用。As4O6的分子结构如1所示,则在该化合物中As原子的杂化轨道数目为__________ ,As原子的第一电离能__________ (填“>”“=”或“<”)O原子的第一电离能。
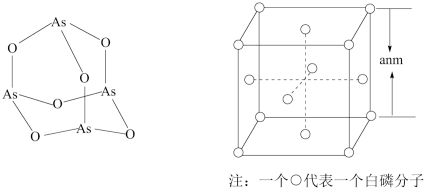
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示。已知晶胞参数为anm,阿伏伽德罗常数的数值为NA,则P4的密度为__________ (列出计算式)g·cm-3。
(1)下列N原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
(2)N3-与Na+具有相同的电子构型,r(N3-)大于r(Na+),原因是
(3)Ca3(PO4)2在食品工业中用作抗结剂、营养增补剂,Ca3(PO4)2中的阴离子空间构型是
A离子键 B.σ键 C.π键 D.氢键
(4)受民间中医启发,科研工作者发现As2O3(俗称砒霜,或写作As4O6)对白血病有明显的治疗作用。As4O6的分子结构如1所示,则在该化合物中As原子的杂化轨道数目为

(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示。已知晶胞参数为anm,阿伏伽德罗常数的数值为NA,则P4的密度为
您最近一年使用:0次



