1 . 缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物,某科学小组依据 、
、 、
、 分子对此进行研究。
分子对此进行研究。
(1)写出B原子的价层电子轨道表示式_______ 。
(2) 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是_______ ,其_______ (能/不能)提供孤对电子与Fe2+形成配位键。
(3)上述三种化合物中,是缺电子化合物的是_______ 。
(4)NH3分子极易溶于水,是说明理由_______ 。
 、
、 、
、 分子对此进行研究。
分子对此进行研究。(1)写出B原子的价层电子轨道表示式
(2)
 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是(3)上述三种化合物中,是缺电子化合物的是
(4)NH3分子极易溶于水,是说明理由
您最近一年使用:0次
解题方法
2 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为___________ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒___________ (分子或离子);
②硫氰酸分子中硫原子的杂化方式为___________ 。
③异硫氰酸的沸点比硫氰酸沸点高的原因是___________ 。
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为___________ pm(列出计算式即可)。

(1)基态铁原子价电子排布式为
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中硫原子的杂化方式为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为

您最近一年使用:0次
名校
解题方法
3 . 请回答下列问题。
(1)某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于___________ (填“晶体或“非晶体”),可通过___________ 方法鉴别。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO) 4属于___________ 晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则晶体熔点NiO___________ FeO(填“<”或“>”)
(3)铜能与类卤素(SCN)2反应生成Cu(SCN) 2,已知SCN-中C原子为sp杂化,则SCN-的结构简式为___________ 。
(4)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2.其中NO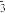 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为___________ 。[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有___________ 。
(1)某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO) 4属于
(3)铜能与类卤素(SCN)2反应生成Cu(SCN) 2,已知SCN-中C原子为sp杂化,则SCN-的结构简式为
(4)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2.其中NO
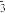 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为
您最近一年使用:0次
4 . 有下列五种物质:
① ②
② ③CH3OH④CH3COOH⑤
③CH3OH④CH3COOH⑤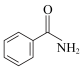
回答问题(1)~(4):
(1)①中碳原子杂化方式分别是_____ 。②中官能团名称是_____ 。
(2)写出②转化成丙烯的化学方程式_____ 。
(3)写出③与④反应的化学方程式_____ 。
(4)⑤在氢氧化钠溶液中反应的化学方程式是_____ 。
(5)下列三组物质能用酸性高锰酸钾溶液鉴别的一组物质是_____ (填字母序号)。
a.乙烯和乙炔 b.乙烯和乙烷 c.苯和环己烷
(6)普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是_____ (填字母序号)。
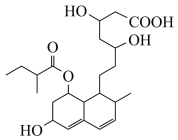
a.该物质能与Na、NaHCO3发生反应
b.能与FeCl3溶液发生显色反应
c.能发生加成、取代、消去反应
d.1mol该物质最多可与1molNaOH反应
①
 ②
② ③CH3OH④CH3COOH⑤
③CH3OH④CH3COOH⑤
回答问题(1)~(4):
(1)①中碳原子杂化方式分别是
(2)写出②转化成丙烯的化学方程式
(3)写出③与④反应的化学方程式
(4)⑤在氢氧化钠溶液中反应的化学方程式是
(5)下列三组物质能用酸性高锰酸钾溶液鉴别的一组物质是
a.乙烯和乙炔 b.乙烯和乙烷 c.苯和环己烷
(6)普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是

a.该物质能与Na、NaHCO3发生反应
b.能与FeCl3溶液发生显色反应
c.能发生加成、取代、消去反应
d.1mol该物质最多可与1molNaOH反应
您最近一年使用:0次
2023-07-27更新
|
165次组卷
|
2卷引用:江西省赣州市第四中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
5 . 哈尔滨工业大学的李惠等人和加州大学洛杉矶分校的黄昱、段镶锋合作合成了具备超轻、高力学强度和超级隔热三大特点的氮化硼(hBNAGs)以及碳化硅( -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
(1)硅原子的价电子排布图为___________ 。B、N、O、Al的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。
① 从原子结构分析B容易与配体形成配位键的原因___________ 。
② 下列有关硼酸及其相关化合物的说法正确的是___________ (填标号)。
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
① 下列有关氨硼烷(NH3BH3)的说法中错误的是___________ (填标号)。
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷中H−N−H的键角___________ (填“>”“<”或“=”)H−B−H的键角。
 -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:(1)硅原子的价电子排布图为
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF
 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。① 从原子结构分析B容易与配体形成配位键的原因
② 下列有关硼酸及其相关化合物的说法正确的是
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
| 元素符号 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷中H−N−H的键角
您最近一年使用:0次
2023-07-06更新
|
106次组卷
|
2卷引用:江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
6 . X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
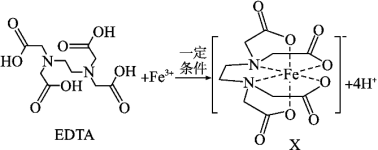
(1)基态Si原子的价层电子的运动状态有_______ 种,若其电子排布式表示为[Ne]3s2 违背了
违背了_______ 。
(2)EDTA中碳原子杂化轨道类型为_______ ,EDTA中四种元素的电负性由小到大的顺序为_______ 。C、N、O第一电离能由小到大的顺序为_______ 。
(3)Fe3+基态价层电子排布式为_______ 。
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是_______ 。
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为_______ 。

(1)基态Si原子的价层电子的运动状态有
 违背了
违背了(2)EDTA中碳原子杂化轨道类型为
(3)Fe3+基态价层电子排布式为
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为
您最近一年使用:0次
名校
解题方法
7 . 2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为________ ,基态Ga原子核外有____ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____ 和+3。
(3)1918年美国人通过反应:HC≡CH+AsCl3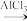 CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________ ;AsCl3分子的空间构型为___________ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(1)基态As原子的价电子排布图为
(2)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)1918年美国人通过反应:HC≡CH+AsCl3
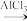 CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为
您最近一年使用:0次
2020-11-16更新
|
393次组卷
|
4卷引用:河南省焦作市博爱英才学校2021届高三开学考试化学试题
河南省焦作市博爱英才学校2021届高三开学考试化学试题(已下线)易错27 分子的立体结构-备战2021年高考化学一轮复习易错题辽宁省南台、岫二、牛庄、海城三中、腾鳌、析木等高级中学2020-2021学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2020-2021学年高二下学期期中考试化学试题
名校
8 . [化学——选修3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为____________
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为____________ (用化学用语表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________ 。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________ ,bc3-离子的空间构型为____________ 。
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式________________________ ,析出深蓝色晶体时加入乙醇的作用是________________________ 。
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为____________ g·cm3。(用含NA、r的表达式表示)

周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)e原子的价层电子排布图为
(2)晶体d、晶体da晶体ac2的熔点由高到低的顺序为
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为
(4)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体。请写出得到深蓝色透明溶液的离子方程式
(5)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为

您最近一年使用:0次
2020-09-09更新
|
426次组卷
|
3卷引用:四川省雅安市雅安中学2020届高三上学期开学摸底考试(9月)化学试题
解题方法
9 . (1) 某元素价层电子排布式为3d64s2,该元素在周期表中位于_____ 区_____ 族。
(2)某元素N能层只有1个电子,其余能层均已填满电子,该元素价层电子排布图为_____ 。
(3) SO2分子中,S原子采用_____ 杂化轨道成键,该分子的价层电子对互斥模型_____ 。
(2)某元素N能层只有1个电子,其余能层均已填满电子,该元素价层电子排布图为
(3) SO2分子中,S原子采用
您最近一年使用:0次
名校
解题方法
10 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________ ,基态时该阳离子的价电子排布式为___________ 。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____ 元素。
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是________________________________________ 。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2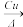 2CH3CHO+2H2O。
2CH3CHO+2H2O。
①乙醇的沸点高于乙醛,其主要原因是_________________________________ ;乙醛分子中π键与σ键的个数比为___________ 。
②乙醛分子中碳原子的杂化轨道类型是___________ 。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
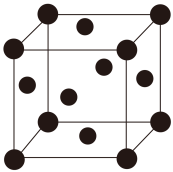
①该铜银合金的化学式是___________________ 。
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为_______ mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为___________ 。(提示:晶胞中原子空间利用率=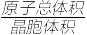 ×100%)
×100%)
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
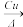 2CH3CHO+2H2O。
2CH3CHO+2H2O。①乙醇的沸点高于乙醛,其主要原因是
②乙醛分子中碳原子的杂化轨道类型是
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为
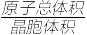 ×100%)
×100%)
您最近一年使用:0次
2020-05-28更新
|
1376次组卷
|
6卷引用:河南省原阳县第一高级中学2021-2022学年高三上学期开学适应性考试理综化学试题



