1 . 氮、磷、硫、氯等非金属元素的单质和化合物在工农业生产中有重要应用。回答下列问题:
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为___________ 。某厂废液中含有2%∼5%的 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是___________ (填标号)。
A. B.
B. C.
C.
(2) 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
① 为
为___________ 元酸(填“一”二”或“三”),磷原子的杂化方式为___________ 。
②利用 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为___________ (填化学式)。
(3)硫代硫酸钠晶体( ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:___________ 。
(4)氯气与氢氧化钠在70℃时反应,生成物中 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为___________ 。
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是A.
 B.
B. C.
C.
(2)
 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①
 为
为②利用
 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为(3)硫代硫酸钠晶体(
 ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:(4)氯气与氢氧化钠在70℃时反应,生成物中
 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 通过化学方法,人们不仅能从大自然中提取物质,还能制备出性质更佳优良的材料。氨是一种重要的化工原料,工业上常用浓氨水检验输送氯气的管道是否泄漏。其反应原理为:
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目___________ 。
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:___________ 。
(3)NH3的电子式为___________ ,其中心原子的杂化类型为 ___________ 。
(4)N2分子中含___________ 个π键。
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:___________ 。
化学性质的变化:___________ 。
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:
(3)NH3的电子式为
(4)N2分子中含
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:
化学性质的变化:
您最近一年使用:0次
名校
解题方法
3 . A和B两种金属的含氮化合物的结构如图所示:

(1)基态Ni原子的核外电子排布式为[Ar]_______ 。
(2)物质A中碳原子的杂化方式为_______ 。
(3)物质A的熔点高于物质B的,主要原因是_______ 。
(4)物质B中不含有的化学键类型有_______。

(1)基态Ni原子的核外电子排布式为[Ar]
(2)物质A中碳原子的杂化方式为
(3)物质A的熔点高于物质B的,主要原因是
(4)物质B中不含有的化学键类型有_______。
| A.金属键 | B.σ键 | C.π键 | D.配位键 |
您最近一年使用:0次
名校
4 . 化合物G可用于药用多肽的结构修饰,其人工合成路线如下:

(1)A分子中碳原子的杂化轨道类型为___________ 。
(2)B的官能团名称为___________ ,B→C的反应类型为___________ 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________ 。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为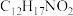 ,其结构简式为
,其结构简式为___________ 。

(1)A分子中碳原子的杂化轨道类型为
(2)B的官能团名称为
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为
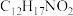 ,其结构简式为
,其结构简式为
您最近一年使用:0次
名校
5 . 《上海市排水“十四五”规划》提出到“十四五”末期,新增污水处理规模约280万立方米/日。聚合氯化铝(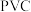 )是一种高效絮凝剂,广泛用于城市给排水净化。工业上制备
)是一种高效絮凝剂,广泛用于城市给排水净化。工业上制备 的一种方法:
的一种方法: 。
。
(1)上述反应所涉及的第二周期元素中,未成对电子数相等的元素有___________ ,能说明两者非金属性强弱的事实是___________ 。
(2)常压、180℃时, 升华形成的二聚体(
升华形成的二聚体( )的结构如图所示,试用“→”标出其中的配位键
)的结构如图所示,试用“→”标出其中的配位键___________ ,其杂化方式为___________ 。

(3)美国科学家宣布发现了铝的某种超原子结构( )具有40个价电子时处于相对稳定状态。请预测稳定的
)具有40个价电子时处于相对稳定状态。请预测稳定的 所带的电荷数为__________。
所带的电荷数为__________。
(4)铝的“超级原子”结构有 、
、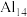 等。这类超级原子和
等。这类超级原子和 类似,最外层电子数为40时处于相对稳定状态,下列说法正确的是__________。
类似,最外层电子数为40时处于相对稳定状态,下列说法正确的是__________。
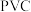 )是一种高效絮凝剂,广泛用于城市给排水净化。工业上制备
)是一种高效絮凝剂,广泛用于城市给排水净化。工业上制备 的一种方法:
的一种方法: 。
。(1)上述反应所涉及的第二周期元素中,未成对电子数相等的元素有
(2)常压、180℃时,
 升华形成的二聚体(
升华形成的二聚体( )的结构如图所示,试用“→”标出其中的配位键
)的结构如图所示,试用“→”标出其中的配位键
(3)美国科学家宣布发现了铝的某种超原子结构(
 )具有40个价电子时处于相对稳定状态。请预测稳定的
)具有40个价电子时处于相对稳定状态。请预测稳定的 所带的电荷数为__________。
所带的电荷数为__________。| A.-1 | B.+2 | C.0 | D.+3 |
(4)铝的“超级原子”结构有
 、
、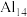 等。这类超级原子和
等。这类超级原子和 类似,最外层电子数为40时处于相对稳定状态,下列说法正确的是__________。
类似,最外层电子数为40时处于相对稳定状态,下列说法正确的是__________。A.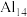 与盐酸反应的化学方程式可表示为: 与盐酸反应的化学方程式可表示为: |
B. 和 和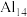 互为同位素 互为同位素 |
C. 和 和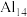 都具有较强的还原性,容易失去电子生成阳离子 都具有较强的还原性,容易失去电子生成阳离子 |
D. 超原子中 超原子中 原子间通过离子键结合 原子间通过离子键结合 |
您最近一年使用:0次
6 . 铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 的核外电子排布式是
的核外电子排布式是___________ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确 的是___________ 。
A. 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2
B.化学键中离子键成分的百分数: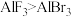
C. 分子中有6对共用电子对
分子中有6对共用电子对
D. 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构
②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是___________ 。
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是___________ 。
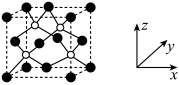
(3)AlP 晶胞结构如下图所示:
①磷化铝晶胞沿着 y轴的投影图为_________ (填选项字母)。
A. B.
B.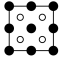 C.
C.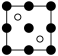 D.
D.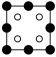
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为_________ g∙cm−3(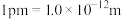 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
(1)能量最低的激发态
 的核外电子排布式是
的核外电子排布式是(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法
A.
 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2B.化学键中离子键成分的百分数:
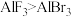
C.
 分子中有6对共用电子对
分子中有6对共用电子对D.
 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是
(3)AlP 晶胞结构如下图所示:

①磷化铝晶胞沿着 y轴的投影图为
A.
 B.
B. C.
C. D.
D.
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为
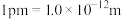 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
您最近一年使用:0次
7 . 由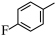 经两步反应合成
经两步反应合成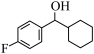 的步骤如下:
的步骤如下:
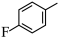
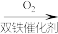
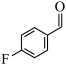
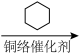
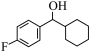
完成下列问题:
(1)上述有机物涉及的3种第二周期元素,其电负性由小到大排序依次是___________ 。
(2)用“*”标记出下图分子中的手性碳原子________ 。
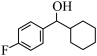
(3)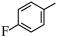 的分子式是
的分子式是___________ ,其中碳原子的杂化类型是___________ ,分子中有___________ 个原子参与形成离域键。
(4)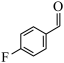 转化为
转化为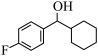 的过程中,C=O键中的
的过程中,C=O键中的___________ (填“σ”或“π”)键断裂,所属的有机反应基本类型是___________ 反应。
 经两步反应合成
经两步反应合成 的步骤如下:
的步骤如下:



完成下列问题:
(1)上述有机物涉及的3种第二周期元素,其电负性由小到大排序依次是
(2)用“*”标记出下图分子中的手性碳原子

(3)
 的分子式是
的分子式是(4)
 转化为
转化为 的过程中,C=O键中的
的过程中,C=O键中的
您最近一年使用:0次
2023-09-10更新
|
254次组卷
|
2卷引用:吉林省长春外国语学校2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
8 . ⅤA族元素(N、P、As、Sb、Bi等)在生活中占有重要地位。请回答:
(1)叠氮酸根离子 的空间结构名称为
的空间结构名称为___________ ;中心氮原子的杂化轨道类型是___________ ;叠氮化钠 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是___________ 。
(2)实验室测得分子式为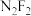 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:
B的结构式为___________ 。
(3)已知P可以与Cl形成多种化合物,如: 、
、 、
、 等,下列说法
等,下列说法不正确 的是___________。
(4)Fe、Sb与O形成的某化合物晶体的晶胞如图。该化合物的化学式为___________ 。
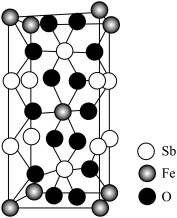
(1)叠氮酸根离子
 的空间结构名称为
的空间结构名称为 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是(2)实验室测得分子式为
 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:| 熔点/℃ | 沸点/℃ | |
| A |  | 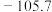 |
| B |  | 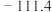 |
(3)已知P可以与Cl形成多种化合物,如:
 、
、 、
、 等,下列说法
等,下列说法A.微粒半径: |
| B.同周期中第一电离能小于P的元素有4种 |
C.根据电负性差异, 的水解产物为 的水解产物为 和 和 |
D.已知 以 以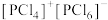 的形式存在,熔融时不导电,可推测熔融时 的形式存在,熔融时不导电,可推测熔融时 可能转化为 可能转化为 |

您最近一年使用:0次
2023-08-08更新
|
554次组卷
|
3卷引用:江西省吉安市第一中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
9 . 我国科学家发现催化剂 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。

(1)Fe元素在元素周期表中的位置是___________ 。
(2)污染物X在电极a上的反应式是___________ 。
(3)科研团队研究了X分别为 、
、 和
和 [也可以写作
[也可以写作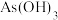 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
①基态As原子的价层电子排布式是___________ 。
② 中的键角
中的键角___________ (填“>”“<”或“=”) 中的键角。
中的键角。
③ 的结构是
的结构是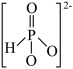 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是___________ 。
(4)比较反应能力:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(5) 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为___________ ( 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意思如下。
(1)Fe元素在元素周期表中的位置是
(2)污染物X在电极a上的反应式是
(3)科研团队研究了X分别为
 、
、 和
和 [也可以写作
[也可以写作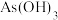 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。①基态As原子的价层电子排布式是
②
 中的键角
中的键角 中的键角。
中的键角。③
 的结构是
的结构是 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是(4)比较反应能力:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(5)
 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
您最近一年使用:0次
2023-05-11更新
|
809次组卷
|
4卷引用:北京市第一六一中学2023-2024学年高三上学期期中测试化学试题
名校
解题方法
10 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1)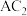 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
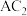 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近一年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:河北省衡水市武强中学2023-2024学年高三上学期期中考试化学试题



