2022高三·全国·专题练习
1 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
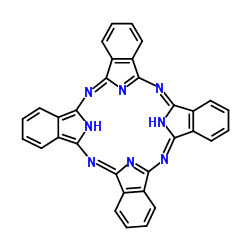
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(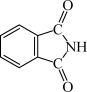 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
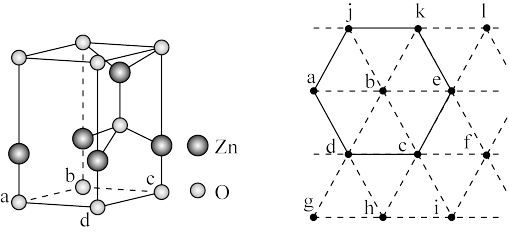
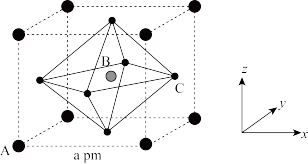
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9158次组卷
|
11卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2022年海南省高考真题变式题15-19(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
名校
解题方法
2 . 2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)已知Sn和Si同族,基态Sn原子价层电子的空间运动状态有_______ 种,基态氧原子的价层电子排布式不能表示为2s22p 2p
2p ,因为这违背了
,因为这违背了_______ (填选项)。
A.泡利原理 B.洪特规则 C.能量最低原理
(2)[B(OH)4]-中硼原子的杂化轨道类型为_______ ,[B(OH)4]-的空间构型为_______ 。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_______ (填选项)。
A.π键 B. σ键 C.配位键 D.极性键
(3)碳酸钡、碳酸镁分解温度较低的是_______ ,分解得到的金属氧化物中,熔点较低的是BaO,其原因是_______ 。
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为_______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为_______ g·cm-3(列出含a、NA的计算式即可)。

(1)已知Sn和Si同族,基态Sn原子价层电子的空间运动状态有
 2p
2p ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
(2)[B(OH)4]-中硼原子的杂化轨道类型为
A.π键 B. σ键 C.配位键 D.极性键
(3)碳酸钡、碳酸镁分解温度较低的是
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2022-04-26更新
|
731次组卷
|
3卷引用:山西省太原市第五中学2022届高三下学期5月阶段性检测理综化学试题
山西省太原市第五中学2022届高三下学期5月阶段性检测理综化学试题四川省遂宁市2021-2022学年高三下学期三诊化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)
解题方法
3 . 我国科学家研究了具有高稳定性的二维硼烯氧化物(BmOn)的超导电性。回答下列问题:
(1)第一电离能介于B、N之间的第二周期元素为_______ (填元素符号)。
(2)①已知二维硼烯氧化物的部分结构如图所示,则该氧化物的化学式为_____ ,其中硼原子的杂化轨道类型为_____ 。

②键长和键角的数值可通过晶体的X射线衍射实验获得。经过该实验测定,二维硼烯氧化物中B-B键的键长大于B-O键的键长,其原因是_______ 。
(3)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因_______ 。
(4)LiBH4 -LiI复合材料在低温下表现出较高的离子电导率。BH 离子中H的化合价为-1,其原因可能是
离子中H的化合价为-1,其原因可能是 _______ ,BH 可以被PS
可以被PS 离子部分取代,PS
离子部分取代,PS 离子的空间结构为
离子的空间结构为_______ 。
(5)Fe3O4是电子导体,其导电率显著高于Fe2O3,这归因于Fe2+和Fe3+中心之间的电子交换。如图甲所示, Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中, Fe2+和另一半 Fe3+填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______ 。FeO 、Fe2O3都具有与Fe3O4相似的立方堆积结构,氧化亚铁晶体的晶胞如图乙所示,已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶体中,与Fe2+紧邻且等距离的Fe2+数目为_______ ;Fe2+与O2-的最短核间距为_______ cm(列出计算式)。

(1)第一电离能介于B、N之间的第二周期元素为
(2)①已知二维硼烯氧化物的部分结构如图所示,则该氧化物的化学式为

②键长和键角的数值可通过晶体的X射线衍射实验获得。经过该实验测定,二维硼烯氧化物中B-B键的键长大于B-O键的键长,其原因是
(3)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因
(4)LiBH4 -LiI复合材料在低温下表现出较高的离子电导率。BH
 离子中H的化合价为-1,其原因可能是
离子中H的化合价为-1,其原因可能是  可以被PS
可以被PS 离子部分取代,PS
离子部分取代,PS 离子的空间结构为
离子的空间结构为(5)Fe3O4是电子导体,其导电率显著高于Fe2O3,这归因于Fe2+和Fe3+中心之间的电子交换。如图甲所示, Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中, Fe2+和另一半 Fe3+填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为

您最近一年使用:0次
4 . 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的px原子轨道上的电子数为____ 个。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是____ (写元素符号)。
(2)Ti的配合物有多种。Ti(CO)6、Ti(H2O) 、TiF
、TiF 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是____ (写元素符号);Ti(H2O) 中∠H—O—H
中∠H—O—H____ (填“大于”、“小于”或“等于”)单个水分子中∠H—O—H;Ti(NO3)4的球棍结构如图,Ti的配位数是____ ,N原子的杂化方式为____ 。
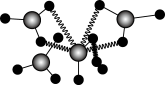
(3)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=____ 。已知原子1、2的分数坐标为(0,0, )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为____ ,设阿伏加德罗常数的值为NA,TiO2的密度为____ g·cm-3(列出计算式)
(1)基态钛原子的px原子轨道上的电子数为
(2)Ti的配合物有多种。Ti(CO)6、Ti(H2O)
 、TiF
、TiF 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是 中∠H—O—H
中∠H—O—H
(3)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=
 )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为
您最近一年使用:0次
2022-03-03更新
|
1172次组卷
|
7卷引用:山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题
山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题山东省济宁市2022届高三下学期3月一模考试化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)必刷卷05-2022年高考化学考前信息必刷卷(山东专用)江西省新八校2022届高三第二次联考理科综合化学试题江西省景德镇一中2022-2023学年高二上学期期中考试化学试题四川省兴文第二中学校2023-2024学年高三上学期期末考试理综试题-高中化学
名校
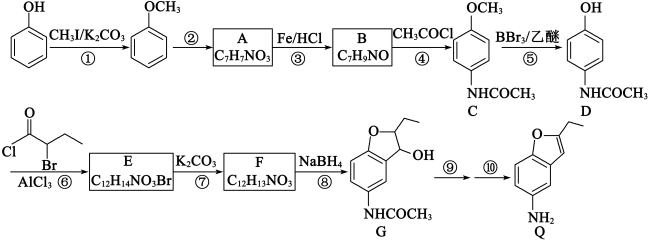
5 . 化合物Q是一种药物的中间体,可利用如下合成路线制备化合物Q;
(1)有机物A的化学名称为__________ ;有机物C中官能团的名称为__________ 。
(2)反应①中加入 的作用是
的作用是____________________ ;合成路线中设计反应①和⑤目的是____________________ 。反应⑦的化学方程式为______________________________ 。下列关于反应③的说法,错误的是__________ (填标号)。
A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性 溶液鉴别物质A和B
溶液鉴别物质A和B
(3)有机物D的同分异构体中,同时含有苯环和硝基的共__________ 种(考虑立体异构);其中核磁共振氢谱显示含3组吸收峰,且吸收峰面积比为6:2:1的同分异构体的结构简式为__________ 。
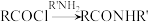
Ⅱ.
(1)有机物A的化学名称为
(2)反应①中加入
 的作用是
的作用是A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性
 溶液鉴别物质A和B
溶液鉴别物质A和B(3)有机物D的同分异构体中,同时含有苯环和硝基的共
您最近一年使用:0次
2024-03-29更新
|
550次组卷
|
3卷引用:2024届山西省朔州市怀仁市第一中学校高三下学期四模理科综合试题-高中化学
解题方法
6 . 半导体砷化硼具有超高的导热系数,有助于电子器件降温散热。回答下列问题:
(1)基态硼原子的价电子排布式为_______ ,根据“对角线规则”,硼的性质与_______ (填名称)相似。
(2)实验测得,砷的第一电离能大于硒的第一电离能,原因是_______ 。
(3)三氧化二砷的分子结构如图所示,其中砷原子的杂化方式是_______ ,1 mol As4O6中含有的σ键数目为_______ 。

(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性由大到小的顺序是_______ 。
(5)氢化物的沸点:SbH3>NH3>AsH3,其理由是_______ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA'C'C是沿如图(a)放置的晶胞对角面取得的截图。

①若该晶体的密度为a g/cm3,设B和As的原子半径分别为rB pm和rAs pm,则原子的空间占有率为_______ ×100%(列出计算表达式,阿伏加德罗常数的值为NA)。
②晶胞中各原子在矩形AA'C'C中的位置为_______ (填“甲”、“乙”、“丙”、“丁”)。
甲. 乙.
乙. 
丙. 丁.
丁. 
(1)基态硼原子的价电子排布式为
(2)实验测得,砷的第一电离能大于硒的第一电离能,原因是
(3)三氧化二砷的分子结构如图所示,其中砷原子的杂化方式是

(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性由大到小的顺序是
(5)氢化物的沸点:SbH3>NH3>AsH3,其理由是
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA'C'C是沿如图(a)放置的晶胞对角面取得的截图。

①若该晶体的密度为a g/cm3,设B和As的原子半径分别为rB pm和rAs pm,则原子的空间占有率为
②晶胞中各原子在矩形AA'C'C中的位置为
甲.
 乙.
乙. 
丙.
 丁.
丁. 
您最近一年使用:0次
名校
解题方法
7 . 硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)氮原子核外有_______ 种不同运动状态的电子。
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:_______ 。
(3)经测定发现,N2O5固体由NO 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为_____ 。
(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为_______ (填元素符号)。
(5) 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为_______ 。
②该晶胞沿体对角线方向的投影图为_______ (填标号)。
a.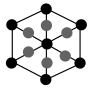 b.
b. 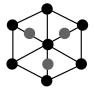 c.
c.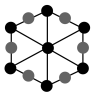 d.
d.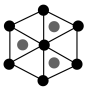
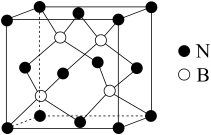
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______ 个硼原子构成。

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______ g/cm3(用含a、b、NA的代数式表示)。
(1)氮原子核外有
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:
(3)经测定发现,N2O5固体由NO
 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为
(5)
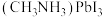 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为
②该晶胞沿体对角线方向的投影图为
a.
 b.
b.  c.
c. d.
d.
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含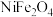 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应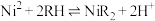 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料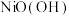 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
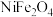 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
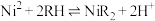 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料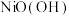 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
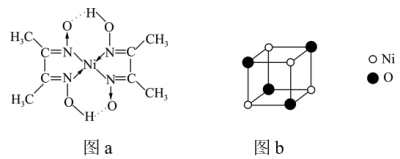
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题
解题方法
9 . 2020年诺贝尔化学奖正式授予法国科学家Emmanuelle Charpentier和美国科学家Jennifer A.Doudna,以表彰其“开发出一种基因组编辑方法”,利用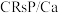 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的
基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的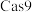 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。

(1)基态C原子价层电子的轨道表达式为_______ 。基态C原子核外电子占据最高能级的电子云轮廓图为_______ 形。
(2)赖氨酸中N原子的杂化轨道类型为_______ 。
(3)C、N、O三种元素的第一电离能由小到大的顺序为_______ ,原因是_______ 。
(4)氨硼烷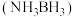 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物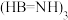 通过反应
通过反应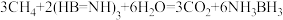 制得。
制得。
①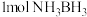 分子中有
分子中有_______ 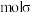 键。
键。
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是_______ 。设 为阿伏加德罗常数的值,若晶胞参数为
为阿伏加德罗常数的值,若晶胞参数为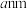 ,则晶体密度为
,则晶体密度为_______  (列出计算式)。
(列出计算式)。
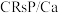 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的
基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的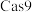 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
(1)基态C原子价层电子的轨道表达式为
(2)赖氨酸中N原子的杂化轨道类型为
(3)C、N、O三种元素的第一电离能由小到大的顺序为
(4)氨硼烷
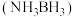 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物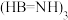 通过反应
通过反应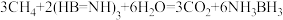 制得。
制得。①
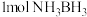 分子中有
分子中有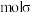 键。
键。②与
 互为等电子体的一种分子为
互为等电子体的一种分子为③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是
 为阿伏加德罗常数的值,若晶胞参数为
为阿伏加德罗常数的值,若晶胞参数为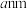 ,则晶体密度为
,则晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
10 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和________ 。含有12mol σ键的K4[Fe(CN)6的物质的量为________ mol。
(3)黄血盐中N原子的杂化方式为______ ;C、N、O的第一电离能由大到小的排序为_____ ,电负性由大到小的排序为________ 。
(4)Fe、Na、K的晶体结构如图所示:
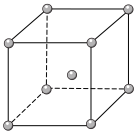
① 钠的熔点比钾更高,原因是__________________________ 。
② Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______ g/cm3。
(1)写出基态Fe3+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)黄血盐中N原子的杂化方式为
(4)Fe、Na、K的晶体结构如图所示:

① 钠的熔点比钾更高,原因是
② Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是
您最近一年使用:0次
2020-01-12更新
|
1072次组卷
|
6卷引用:山西省晋中市和诚中学2019-2020学年高二4月月考化学试题



