解题方法
1 . 完成下列小题
(1)胆矾的结构可表示如下:

则胆矾晶体中含有_____ (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键 E.氢键
(2)向硫酸铜溶液里逐滴加入氨水至生成的蓝色沉淀溶解,得到深蓝色的透明溶液,蓝色沉淀溶解的离子方程式为_____ ,该配离子中的配体跟水分子相比,_____ 较容易跟铜离子形成配位键,原因是_____ 。
(3)配合物 中,配位原子是
中,配位原子是_____ ,该配合物的结构式为_____ (标出配位键)该配合物中, 键与Π键的个数比为
键与Π键的个数比为_____ 。
(1)胆矾的结构可表示如下:

则胆矾晶体中含有
A.配位键 B.离子键 C.极性共价键 D.非极性共价键 E.氢键
(2)向硫酸铜溶液里逐滴加入氨水至生成的蓝色沉淀溶解,得到深蓝色的透明溶液,蓝色沉淀溶解的离子方程式为
(3)配合物
 中,配位原子是
中,配位原子是 键与Π键的个数比为
键与Π键的个数比为
您最近一年使用:0次
名校
解题方法
2 . 羰基铁[Fe(CO)5]广泛用于催化剂,汽油抗爆剂等,为黄色粘稠状液体,熔点为-20℃,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
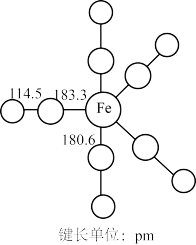
(1)Fe(CO)5晶体类型为___________ 。(填“离子晶体”或“分子晶体”)
(2)下列说法正确的是___________。

(1)Fe(CO)5晶体类型为
(2)下列说法正确的是___________。
| A.中心Fe原子可能采取sp3杂化 | B.配体与Fe原子所形成的配位键的键能相同 |
| C.Fe在周期表中位于Ⅷ族,属于d区元素 | D.制备Fe(CO)5应在隔绝空气的条件下进行 |
您最近一年使用:0次
解题方法
3 . (1)碳元素的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为___ 。
(2)碳元素、氧元素分别与氢元素形成的最简单化合物中,沸点较高的为___ (写化学式),原因是___ 。
(3)R为铬元素,R的一种配合物的化学式为RCl3·6H2O。已知0.01molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此配合物最可能是___ 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(4)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:___ ,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出反应的离子方程式为:___ 。
(2)碳元素、氧元素分别与氢元素形成的最简单化合物中,沸点较高的为
(3)R为铬元素,R的一种配合物的化学式为RCl3·6H2O。已知0.01molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此配合物最可能是
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(4)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:
您最近一年使用:0次
解题方法
4 . (1)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ 。
(2)[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
(3)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___________ (填元素符号)。
(4)Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有___________ mol σ键。
(5)计算下列各微粒中心原子的杂化轨道数,判断中心原子的杂化轨道类型,写出VSEPR模型名称。

___________ 、___________ 、___________ 。
(2)[Ni(NH3)6]SO4中阴离子的立体构型是
(3)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是
(4)Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有
(5)计算下列各微粒中心原子的杂化轨道数,判断中心原子的杂化轨道类型,写出VSEPR模型名称。

您最近一年使用:0次
20-21高二·全国·课时练习
名校
5 . 回答下列问题:
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是________________ 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在________ (填序号,下同)。
a.离子键 b.配位键 c.共价键
(3)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是________ 。
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.[Cu(NH3)4]2+的立体结构为正四面体形
D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道
(4)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有________ 和________ 。
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.配位键 c.共价键
(3)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.[Cu(NH3)4]2+的立体结构为正四面体形
D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道
(4)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有
您最近一年使用:0次
名校
解题方法
6 . (1)配合物 是钴的重要化合物,中心原子的配位数为
是钴的重要化合物,中心原子的配位数为______ ,Co3+钴离子的电子排布式:_____________ 。
(2) 具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则
具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为___________ 。
(3)铜是重要的过渡元素,能形成多种配合物如Cu2+与乙二胺可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是__________ (填字母代号)。
a.配位键 b.极性键 c.离子键 d.非极性键
②乙二胺和三甲胺 均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
均属于胺。但乙二胺比三甲胺的沸点高很多,原因是_________________ 。
 是钴的重要化合物,中心原子的配位数为
是钴的重要化合物,中心原子的配位数为(2)
 具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则
具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为(3)铜是重要的过渡元素,能形成多种配合物如Cu2+与乙二胺可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是
a.配位键 b.极性键 c.离子键 d.非极性键
②乙二胺和三甲胺
 均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
您最近一年使用:0次
2021-03-04更新
|
781次组卷
|
7卷引用:3.4 配合物与超分子(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
(已下线)3.4 配合物与超分子(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)第三章晶体结构与性质(基础卷)湖南省师范大学附属中学2020-2021学年高二上学期期末考试化学试题山东省滨州市博兴县、阳信县2020-2021学年高二下学期联合期中考试化学试题浙江省台州市九校联盟2021-2022学年高二下学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二下学期4月月考化学试题湖南省衡阳市衡阳县第四中学2022-2023学年高二下学期期中考试化学试题
7 . B、C、N、 是几种常见的非金属元素,其形成的各种化合物在自然界中广泛存在。
是几种常见的非金属元素,其形成的各种化合物在自然界中广泛存在。
(1)基态硅原子的电子排布式为_______ ;C、N、O元素的第一电离能由大到小的顺序为_______ 。
(2) 与一定量的水可形成如图甲所示晶体R。
与一定量的水可形成如图甲所示晶体R。
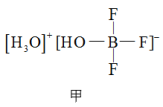
①晶体R中各种微粒间的作用力涉及_______ (填序号);
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R中阴离子的空间结构为_______ 。
(3)乙二胺( )与
)与 溶液可形成配离子(结构如图乙所示),乙二胺分子中氮原子的杂化类型为
溶液可形成配离子(结构如图乙所示),乙二胺分子中氮原子的杂化类型为_______ 。
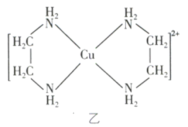
乙二胺和三甲胺 均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是
均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是_______ 。
 是几种常见的非金属元素,其形成的各种化合物在自然界中广泛存在。
是几种常见的非金属元素,其形成的各种化合物在自然界中广泛存在。(1)基态硅原子的电子排布式为
(2)
 与一定量的水可形成如图甲所示晶体R。
与一定量的水可形成如图甲所示晶体R。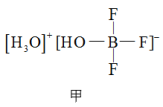
①晶体R中各种微粒间的作用力涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R中阴离子的空间结构为
(3)乙二胺(
 )与
)与 溶液可形成配离子(结构如图乙所示),乙二胺分子中氮原子的杂化类型为
溶液可形成配离子(结构如图乙所示),乙二胺分子中氮原子的杂化类型为
乙二胺和三甲胺
 均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是
均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是
您最近一年使用:0次
2021-02-20更新
|
583次组卷
|
2卷引用:高二选择性必修2(人教版2019)第三章 晶体结构与性质 第三章素养检测
8 . 臭氧( )在
)在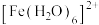 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间结构为
的空间结构为___________ (用文字描述)。
(2) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(3) 分子中
分子中 键与π键的数目比
键与π键的数目比
___________ 。
 )在
)在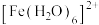 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间结构为
的空间结构为(2)
 基态核外电子排布式为
基态核外电子排布式为(3)
 分子中
分子中 键与π键的数目比
键与π键的数目比
您最近一年使用:0次
2021-02-19更新
|
445次组卷
|
2卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 C高考挑战区
9 . (1) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是______ ,中心原子的杂化形式为______ , 中存在
中存在______ 。
A.离子键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
(2)根据价电子对互斥理论, 的气态分子中,中心原子价电子对数不同于其他分子的是
的气态分子中,中心原子价电子对数不同于其他分子的是______ 。下图为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。气态三氧化硫以单分子形式存在,其分子的空间结构为______ ,其中共价键的类型有______ 种。
(3)《中华本草》等中医典籍中,记载了炉甘石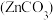 入药,可用于治疗皮肤炎症或表面创伤。
入药,可用于治疗皮肤炎症或表面创伤。
① 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是______ ;
② 不溶于有机溶剂而
不溶于有机溶剂而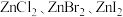 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是______ 。
③ 中,阴离子空间结构为
中,阴离子空间结构为______ ,C原子的杂化形式为______ 。
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是 中存在
中存在A.离子键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键(2)根据价电子对互斥理论,
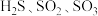 的气态分子中,中心原子价电子对数不同于其他分子的是
的气态分子中,中心原子价电子对数不同于其他分子的是 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(3)《中华本草》等中医典籍中,记载了炉甘石
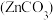 入药,可用于治疗皮肤炎症或表面创伤。
入药,可用于治疗皮肤炎症或表面创伤。①
 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是②
 不溶于有机溶剂而
不溶于有机溶剂而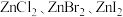 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是③
 中,阴离子空间结构为
中,阴离子空间结构为
您最近一年使用:0次
2021-02-07更新
|
156次组卷
|
2卷引用:鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升
名校
解题方法
10 . 钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)Co2+基态核外电子排布式为___________ 。
(2)NO 的空间结构为
的空间结构为___________ 。
(3)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是___________ 和___________ (填元素符号)。
②C、H、N的电负性从大到小顺序为___________ 。
③bte分子中碳原子轨道杂化类型为___________ 和___________ 。
④1mol bte分子中含 键的数目为
键的数目为___________ mol。
(1)Co2+基态核外电子排布式为
(2)NO
 的空间结构为
的空间结构为(3)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是
②C、H、N的电负性从大到小顺序为
③bte分子中碳原子轨道杂化类型为
④1mol bte分子中含
 键的数目为
键的数目为
您最近一年使用:0次
2020-12-15更新
|
563次组卷
|
4卷引用:2.2 分子的空间结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
(已下线)2.2 分子的空间结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)江苏省如皋中学2020-2021学年高二上学期第二次阶段考试化学(创新班)试题(已下线)第02章 微粒间相互作用与物质性质 (A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题



