名校
解题方法
1 . 某化合物具漂白性,主要用于染色工艺,其结构如图所示,其中W、X、Y、M、Z是原子序数依次递增的短周期主族元素,且Y和 同主族,下列说法错误的是
同主族,下列说法错误的是
 同主族,下列说法错误的是
同主族,下列说法错误的是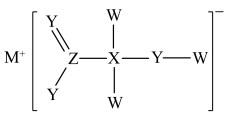
A.电负性: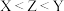 | B. 和 和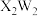 均为极性分子 均为极性分子 |
| C.MW与水反应后的溶液呈碱性 | D. 利 利 的VSEPR模型名称均为平面三角形 的VSEPR模型名称均为平面三角形 |
您最近一年使用:0次
2024-05-27更新
|
395次组卷
|
5卷引用:选择题11-15
2 . X、Y、Z、W为同一短周期的主族元素,基态Y原子L层电子总数是内层电子总数的2倍,上述四种元素形成阴离子的结构如图。下列说法正确的是

| A.ZW2为极性分子 | B.第一电离能:Z>W>Y |
| C.X元素位于元素周期表的s区 | D.最简单氢化物的热稳定性:Z>W>Y |
您最近一年使用:0次
2024-05-15更新
|
151次组卷
|
3卷引用:选择题1-5
2024高三·全国·专题练习
3 . THPC即四羟甲基氯化磷[P(CH2OH)4Cl],主要用于织物阻燃剂,制取THPC反应的化学方程式为4HCHO+HCl+PH3=P(CH2OH)4Cl,下列有关说法正确的是
| A.基态P原子核外电子的空间运动状态有9种 |
| B.PH3属于非极性分子 |
C.Cl-的结构示意图为 |
D.羟基的电子式为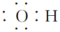 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
4 . 下列关于NCl3、AsCl3、AsCl5等分子的说法正确的是
| A.AsCl3是由极性键构成的非极性分子 |
| B.N—Cl键的键能大于As—Cl键的键能,所以NCl3的沸点大于AsCl3 |
| C.键角:AsCl3>NCl3 |
| D.AsCl3中As—Clσ键是由As原子的sp3杂化轨道和Cl的3p轨道重叠形成 |
您最近一年使用:0次
2024高三·全国·专题练习
5 . 二氧化碳可制备乙烯,反应为2CO2+6H2=C2H4+4H2O。下列说法正确的是
A.基态氧原子的轨道表示式: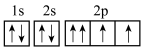 |
| B.乙烯的结构简式:CH2CH2 |
| C.H2O的电子式:H:O:H |
| D.CO2为非极性分子 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
6 . 第VA族元素的原子可与Cl结合形成NCl3、AsCl3、AsCl5等分子。化合价为+3的铬的卤化物有CrF3、CrCl3等,制备三氯化铬的主要反应式为Cr2O3+3CCl4 2CrCl3+3COCl2。CrCl3溶于水得到的配合物为[Cr(H2O)4Cl2]Cl。已知CrCl3、CrF3的熔点依次为83℃、1100℃。下列有关物质的说法正确的是
2CrCl3+3COCl2。CrCl3溶于水得到的配合物为[Cr(H2O)4Cl2]Cl。已知CrCl3、CrF3的熔点依次为83℃、1100℃。下列有关物质的说法正确的是
 2CrCl3+3COCl2。CrCl3溶于水得到的配合物为[Cr(H2O)4Cl2]Cl。已知CrCl3、CrF3的熔点依次为83℃、1100℃。下列有关物质的说法正确的是
2CrCl3+3COCl2。CrCl3溶于水得到的配合物为[Cr(H2O)4Cl2]Cl。已知CrCl3、CrF3的熔点依次为83℃、1100℃。下列有关物质的说法正确的是| A.[Cr(H2O)4Cl2]Cl的中心离子配位数为7 |
| B.CCl4是极性键形成的非极性分子 |
| C.CrCl3和CrF3晶体类型相同 |
| D.1mol[Cr(H2O)4Cl2]Cl和足量硝酸银溶液反应生成3molAgCl |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
7 . 根据信息,回答下列问题。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
(1)基态Cu原子的未成对电子占据原子轨道的形状为_______ 。
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是_______ (填分子式)。
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:_______ 。
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择_______ 滴定管。
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为_______ 。
③计算甘氨酸亚铁晶体中铁元素的质量分数____ (用百分数表示,保留小数点后一位,写出计算过程)。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。(1)基态Cu原子的未成对电子占据原子轨道的形状为
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
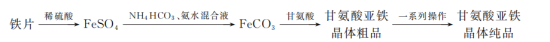
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为
③计算甘氨酸亚铁晶体中铁元素的质量分数
您最近一年使用:0次
2024高三·全国·专题练习
8 . 对下列事实的解释错误的是
| 选项 | 事实 | 解释 |
| A | 稳定性:HF>HI | HF分子间存在氢键,HI分子间不存在氢键 |
| B | 键角:NH >H2O >H2O | 中心原子均采取sp3杂化,孤电子对有较大的斥力 |
| C | 熔点:SiO2>SO2 | SiO2是共价晶体,SO2是分子晶体;共价键比分子间作用力强 |
| D | 酸性:CF3COOH>CCl3COOH | F的电负性大于Cl,F-C的极性大于Cl-C,使F3C-的极性大于Cl3C-的极性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 物质的结构决定其性质。下列实例与解释相符的是
| 选项 | 实例 | 解释 |
| A |  为极性分子 为极性分子 |  中心原子采用 中心原子采用 杂化,存在孤电子对所以结构为V形 杂化,存在孤电子对所以结构为V形 |
| B | Ge原子间难以形成 键 键 | Ge的原子半径较大,未杂化的p轨道很难重叠 |
| C |  的熔点高于 的熔点高于 | 原子半径:O<S,键能:H-O>H-S,所以 的熔点较高 的熔点较高 |
| D |  的酸性强于 的酸性强于 |  属于推电子基团,使—COOH更易电离出 属于推电子基团,使—COOH更易电离出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 .  为一种重要的化工原料,其组成元素
为一种重要的化工原料,其组成元素 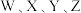 为原子序数依次增大的短周期主族元素,且
为原子序数依次增大的短周期主族元素,且  的一种核素常用于检测文物的年代,
的一种核素常用于检测文物的年代, 的最外层电子数是内层电子数的3倍,下列说法
的最外层电子数是内层电子数的3倍,下列说法错误 的是
 为一种重要的化工原料,其组成元素
为一种重要的化工原料,其组成元素 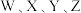 为原子序数依次增大的短周期主族元素,且
为原子序数依次增大的短周期主族元素,且  的一种核素常用于检测文物的年代,
的一种核素常用于检测文物的年代, 的最外层电子数是内层电子数的3倍,下列说法
的最外层电子数是内层电子数的3倍,下列说法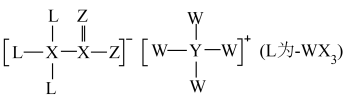
A.电负性: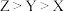 |
B.氢化物的沸点: |
C. 元素对应的单质不一定是非极性分子 元素对应的单质不一定是非极性分子 |
| D.由W、Y、Z三种元素组成的化合物一定抑制水的电离 |
您最近一年使用:0次



