名校
1 . 短周期元素X、Y、Z原子序数依次递增,且原子序数之和为31,三种元素形成的一种化合物结构如图所示。下列说法错误的是
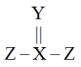
| A.最高价氧化物的水化物的酸性:Z>X | B.简单氢化物沸点:X<Y |
| C.原子半径:X<Y<Z | D.元素Y能形成含有非极性键的18电子分子 |
您最近一年使用:0次
解题方法
2 . 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。如表是元素周期表的一部分,数字①~⑨代表前四周期的九种主族元素。请按题目要求回答下列问题:___________ ;元素①有:H、D、T三种质子数相同,中子数不同的核素,它们互称为___________ ,物质DT属于___________ (选填“单质”、“化合物”)。
(2)写出元素①与元素②可形成的10电子分子的电子式___________ ;写出元素④最高价氧化物的水化物的电子式___________ 。
(3)③、④、⑤、⑦简单离子的半径由大到小的顺序是___________ (用离子符号作答)。
(4)②与⑥两种元素简单氢化物的沸点从高到低排序___________ (用化学式作答)。
某小组同学设计实验比较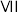 A族元素的非金属性:Cl>Br>I。
A族元素的非金属性:Cl>Br>I。
甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝。 充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的
充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的 层变为紫红色。
层变为紫红色。
(5)①上述___________ (选填“甲同学”、“乙同学”或“两位同学”)的实验能证明非金属性:Cl>Br>I。
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有___________ 。
A. 、
、 、
、 的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
C.HCl、HBr、HI的沸点逐渐升高 D.Cl-、Br-、I-的还原性逐渐增强

(2)写出元素①与元素②可形成的10电子分子的电子式
(3)③、④、⑤、⑦简单离子的半径由大到小的顺序是
(4)②与⑥两种元素简单氢化物的沸点从高到低排序
某小组同学设计实验比较
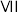 A族元素的非金属性:Cl>Br>I。
A族元素的非金属性:Cl>Br>I。甲同学设计实验如图1所示:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝。

 充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的
充分反应后,静置A中液体为橙黄色,将A中液体滴入试管内,取下试管,充分振荡,试管中的 层变为紫红色。
层变为紫红色。(5)①上述
②除了利用卤素单质间的置换反应,下列可作为卤族元素非金属性递变规律的判断依据有
A.
 、
、 、
、 的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱
的熔点逐渐升高 B.HCl、HBr、HI的热稳定性逐渐减弱C.HCl、HBr、HI的沸点逐渐升高 D.Cl-、Br-、I-的还原性逐渐增强
您最近一年使用:0次
解题方法
3 . 下列物质的性质比较,正确的是
A.热稳定性: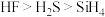 | B.离子半径大小: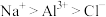 |
C.酸性强弱: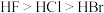 | D.沸点: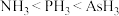 |
您最近一年使用:0次
名校
解题方法
4 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: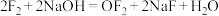 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: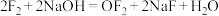 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
199次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期3月月考化学试题
5 . 短周期元素W、X、Y、Z的原子序数依次增大,W与Y,X与Z分别位于同一主族,W与X可形成两种常见气体WX2和WX,Y原子的内层电子总数是其最外层电子数的2.5倍,下列叙述中不正确的是
| A.H2X的沸点低于H2Z的沸点 |
| B.原子半径大小顺序为:X<W<Z<Y |
| C.WX2、ZX2的化学键类型相同 |
| D.WX2分子中所有原子最外层都已满足8电子结构 |
您最近一年使用:0次
名校
6 . 下列“类比”结果正确的是
A. 的溶解度比 的溶解度比 的大,则 的大,则 的溶解度比 的溶解度比 的大 的大 |
B. 分子的空间构型为正四面体形,则 分子的空间构型为正四面体形,则 分子的空间构型也为正四面体形 分子的空间构型也为正四面体形 |
C. 的沸点比 的沸点比 的高,则 的高,则 的沸点比 的沸点比 的高 的高 |
D. 固体和浓硫酸反应可制备 固体和浓硫酸反应可制备 ,则 ,则 固体和浓硫酸反应可制备 固体和浓硫酸反应可制备 |
您最近一年使用:0次
名校
解题方法
7 . 下列关于晶体的说法正确的个数是
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、 、
、 晶体的熔点依次降低
晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤形成氢键的三个原子不一定在同一条直线上
⑥ 晶体中每个硅原子与两个氧原子以共价键相结合
晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、
 、
、 晶体的熔点依次降低
晶体的熔点依次降低④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤形成氢键的三个原子不一定在同一条直线上
⑥
 晶体中每个硅原子与两个氧原子以共价键相结合
晶体中每个硅原子与两个氧原子以共价键相结合⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2022-07-18更新
|
241次组卷
|
2卷引用:重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题
名校
8 . 下列说法正确的是
| A.C3H6和C4H8一定互为同系物 |
| B.NH3的沸点比PH3的沸点更高 |
| C.234U和238U是铀的两种同位素,238 U转换成234U是化学变化 |
| D.16O=C=18O 为某种二氧化碳分子的结构式,该分子含非极性共价键 |
您最近一年使用:0次
解题方法
9 . 类比推理是化学中常用的思维方法,下列推理正确的是
A. 的沸点高于 的沸点高于 ,推测 ,推测 的沸点也高于 的沸点也高于 |
B. 与 与 反应生成 反应生成 与 与 ,推测 ,推测 与 与 反应生成 反应生成 与 与 |
C. 气体通入足量 气体通入足量 溶液生成 溶液生成 和 和 ,推测 ,推测 气体通入足量 气体通入足量 溶液生成 溶液生成 和 和 |
D. 为直线形分子,推测 为直线形分子,推测 (氧硫化碳)也是直线形分子 (氧硫化碳)也是直线形分子 |
您最近一年使用:0次
名校
解题方法
10 . 根据元素周期律,由下列事实进行归纳推测,推测合理的是
| 选项 | 事实 | 推测 |
| A | 氨气易于溶水生成NH3·H2O | 磷化氢易溶于水生成PH3·H2O |
| B | Si是半导体材料,同主族的Ge也是半导体材料 | 第IVA族的元素的单质都可作半导体材料 |
| C | HCl在1500℃时分解,HI在300℃ 时分解 | HBr的分解温度介于二者之间 |
| D | H2Se的沸点比H2S的高 | H2S的沸点比H2O的高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-05更新
|
213次组卷
|
2卷引用:重庆市第一中学2019-2020学年高一下学期期末考试化学试题



