名校
解题方法
1 . 下列关于分子的结构或性质的解释正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 键角: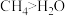 |  的键长大于 的键长大于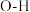 的键长 的键长 |
| B | 用乙酸乙酯而不用水溶解油漆 | 乙酸乙酯与油漆中的成分极性都较小,利用了相似相溶原理,而水分子极性较大,对油漆溶解效果不好 |
| C | 酸性: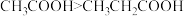 | 烃基 越长,推电子效应越小,羧基中羟基的极性越大,羧酸的酸性越弱 越长,推电子效应越小,羧基中羟基的极性越大,羧酸的酸性越弱 |
| D | 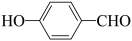 的沸点高于 的沸点高于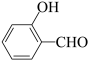 | 因为 分子间的范德华力大于 分子间的范德华力大于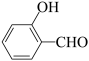 分子间的范德华力 分子间的范德华力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-09更新
|
580次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构如图所示。X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,X原子中电子只有一种自旋方向,Y、Z、Q为同一周期元素,W的原子核外有3个未成对电子。下列说法错误的是
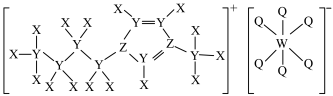
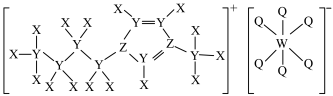
| A.简单离子半径:W>Z>Q |
| B.Z 和 W 的简单氢化物的沸点:Z>W |
| C.X 分别与 Y、Z 均能形成既含极性键又含非极性键的化合物 |
| D.Q、Z、W 的最高价氧化物对应的水化物的酸性:Q>Z>W |
您最近一年使用:0次
2024-02-15更新
|
144次组卷
|
2卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
名校
解题方法
3 . 物质的结构与性质遵循一定的规律,但也有“异常”情况,下列解释有误的是
| 选项 | 一般规律 | “异常”情况及解释 |
| A | 共价键有方向性 | 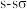 键无方向性,因为s原子轨道为球形 键无方向性,因为s原子轨道为球形 |
| B | 由同种原子构成的分子是非极性分子 |  是极性分子,因为 是极性分子,因为 分子中正负电荷中心不重合 分子中正负电荷中心不重合 |
| C | 同类型化学键,共价键键长越短,键能越大 | 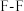 的键长比 的键长比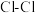 的短,但键能小,因为氟原子的半径小,两个氟原子形成共价键时,原子核之间的距离很近,斥力很大 的短,但键能小,因为氟原子的半径小,两个氟原子形成共价键时,原子核之间的距离很近,斥力很大 |
| D | 组成和结构相似的物质,相对分子质量越大,范德华力越大,熔、沸点越高 | 熔、沸点: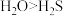 ,因为键能 ,因为键能 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-14更新
|
263次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
名校
4 . 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。下列说法正确的是
A. 的空间构型为平面三角形 的空间构型为平面三角形 | B. 的水溶液不能导电 的水溶液不能导电 |
C. 与 与 能形成分子间氢键 能形成分子间氢键 | D.氨催化氧化制硝酸是利用了 的氧化性 的氧化性 |
您最近一年使用:0次
名校
5 . 我国长征系列运载火箭采用偏二甲肼(C2H8N2)和 作发动机推进剂,产物为氨气、二氧化碳和水,无污染。下列有关说法不正确的是
作发动机推进剂,产物为氨气、二氧化碳和水,无污染。下列有关说法不正确的是
 作发动机推进剂,产物为氨气、二氧化碳和水,无污染。下列有关说法不正确的是
作发动机推进剂,产物为氨气、二氧化碳和水,无污染。下列有关说法不正确的是A.基态N的价电子排布图为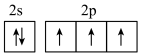 |
| B.N、O的电负性较大,其单质通常比较活泼 |
| C.偏二甲肼分子间存在氢键,沸点较高 |
| D.二氧化碳为非极性分子,水分子和偏二甲肼为极性分子 |
您最近一年使用:0次
2024-01-07更新
|
250次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题
解题方法
6 . 下列有关物质的结构与性质的说法错误的是
| A.液晶是晶体,具有各向异性 |
B.已知: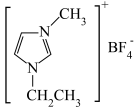 常温下呈液态,推测其是离子液体 常温下呈液态,推测其是离子液体 |
| C.水变为固态冰体积变大的主要原因是形成更多氢键且氢键具有方向性 |
| D.甘油酸(CH2OHCHOHCOOH)中含有一个手性碳原子,是手性分子 |
您最近一年使用:0次
2023-08-31更新
|
235次组卷
|
3卷引用:湖南省部分学校2023-2024学年高三8月开学考试化学试题
7 . 已知吡啶(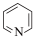 )中含有与苯类似的
)中含有与苯类似的 大π键,下列有关叙述正确的是
大π键,下列有关叙述正确的是
 )中含有与苯类似的
)中含有与苯类似的 大π键,下列有关叙述正确的是
大π键,下列有关叙述正确的是| A.吡啶中N原子的价层孤电子对占据sp杂化轨道 |
| B.在水中的溶解度,吡啶远大于苯的原因只是相似相溶原理 |
C. 、 、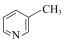 、 、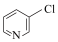 的碱性随N原子电子云密度的增大而增强,则其中碱性最弱的是 的碱性随N原子电子云密度的增大而增强,则其中碱性最弱的是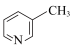 |
D.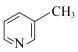 与 与 互为同系物 互为同系物 |
您最近一年使用:0次
名校
8 . W、X、Y、Z为分属不同周期的主族元素,原子序数依次增大且小于20,四种元素形成的化合物在农业上常用作肥料,结构如图。下列说法正确的是
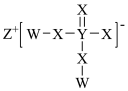
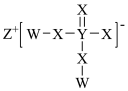
| A.简单离子半径:Z>Y |
| B.X、Y分别与W形成的简单化合物的沸点:X>Y |
| C.X与其它三种元素均只能形成两种化合物 |
| D.X与Z形成的化合物溶于水,可使紫色石蕊试液变红 |
您最近一年使用:0次
名校
解题方法
9 . 下列化学用语表述正确的是
A.N2H4的结构式: |
B.过氧化氢的电子式: |
C.HCO 的电离方程式:HCO 的电离方程式:HCO +H2O +H2O H3O++CO H3O++CO |
D.邻羟基苯甲醛分子内氢键示意图: |
您最近一年使用:0次
名校
10 . 铁及其化合物在生活、生产中有着广泛应用。 (易升华,易水解)是常见的化学试剂,某学习小组开展了与
(易升华,易水解)是常见的化学试剂,某学习小组开展了与 相关的系列实验,请回答下列问题:
相关的系列实验,请回答下列问题:
I.铁粉制备 (实验装置如图所示)
(实验装置如图所示)
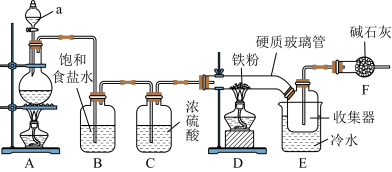
(1)基态 的电子排布式为
的电子排布式为
_________ 。A中实验室制备 的离子方程式为
的离子方程式为_________ ;
(2)装置中F的作用:________ ;
Ⅱ. 在水溶液中能够水解产生胶团从而具有净水作用。
在水溶液中能够水解产生胶团从而具有净水作用。
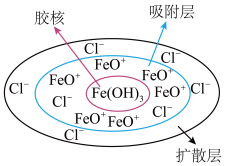
(3) 胶团如图所示,在静电吸附作用下,胶团可以除去废水中含
胶团如图所示,在静电吸附作用下,胶团可以除去废水中含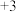 价的砷微粒是
价的砷微粒是___ 。(已知: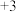 价砷元素存在形式为
价砷元素存在形式为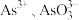 )
)
(4)为探究 和添加助凝剂对
和添加助凝剂对 净水效果的影响,①实验小组选取一种含
净水效果的影响,①实验小组选取一种含 价的砷微粒废液进行探究实验,请将下列表格内容
价的砷微粒废液进行探究实验,请将下列表格内容补充完整 。已知:净水效果可用相同时间内废液中含 价的砷微粒变化来衡量。废液中砷微粒越高,代表废液污染越严重。
价的砷微粒变化来衡量。废液中砷微粒越高,代表废液污染越严重。
②实验结论一:通过1、2、3组实验,发现随着 增大,净水效果依次增强。
增大,净水效果依次增强。 减小,
减小, 净水效果减弱的原因是
净水效果减弱的原因是_________ 。
③实验结论二:添加助凝剂能够显著提高净水效果。该实验结论成立的判断依据是_________ 。(用表中数据表示)
Ⅲ.
(5)① 可与噻吩(
可与噻吩(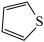 )和吡咯(
)和吡咯(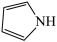 )形成配位化合物。噻吩、吡咯是类似于苯的芳香化合物,环中的五个原子形成了大
)形成配位化合物。噻吩、吡咯是类似于苯的芳香化合物,环中的五个原子形成了大 键。噻吩难溶于水,吡咯能溶于水,原因是吡咯能与水形成分子间
键。噻吩难溶于水,吡咯能溶于水,原因是吡咯能与水形成分子间_________ ,而噻吩不能。
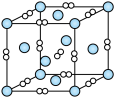
②一个立方体结构的 晶胞如图所示,已知阿伏加德罗数值为
晶胞如图所示,已知阿伏加德罗数值为 ,
, 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为_________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 (易升华,易水解)是常见的化学试剂,某学习小组开展了与
(易升华,易水解)是常见的化学试剂,某学习小组开展了与 相关的系列实验,请回答下列问题:
相关的系列实验,请回答下列问题:I.铁粉制备
 (实验装置如图所示)
(实验装置如图所示)
(1)基态
 的电子排布式为
的电子排布式为
 的离子方程式为
的离子方程式为(2)装置中F的作用:
Ⅱ.
 在水溶液中能够水解产生胶团从而具有净水作用。
在水溶液中能够水解产生胶团从而具有净水作用。(3)
 胶团如图所示,在静电吸附作用下,胶团可以除去废水中含
胶团如图所示,在静电吸附作用下,胶团可以除去废水中含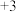 价的砷微粒是
价的砷微粒是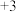 价砷元素存在形式为
价砷元素存在形式为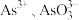 )
)
(4)为探究
 和添加助凝剂对
和添加助凝剂对 净水效果的影响,①实验小组选取一种含
净水效果的影响,①实验小组选取一种含 价的砷微粒废液进行探究实验,请将下列表格内容
价的砷微粒废液进行探究实验,请将下列表格内容 价的砷微粒变化来衡量。废液中砷微粒越高,代表废液污染越严重。
价的砷微粒变化来衡量。废液中砷微粒越高,代表废液污染越严重。| 组别 | 废液体积 |
| 饱和 溶液用量 溶液用量 | 添加的助凝剂 | 净水前砷微粒浓度 | 净水 后砷微粒浓度 后砷微粒浓度 |
1 |
| 1.0 | 2滴 | 无 | Al | B1 |
2 |
| 2.0 | 2滴 | A2 | B2 | |
3 |
| 2滴 | A3 | B3 | ||
4 |
| 3.0 | 2滴 | 有 | A4 | B4 |
 增大,净水效果依次增强。
增大,净水效果依次增强。 减小,
减小, 净水效果减弱的原因是
净水效果减弱的原因是③实验结论二:添加助凝剂能够显著提高净水效果。该实验结论成立的判断依据是
Ⅲ.
(5)①
 可与噻吩(
可与噻吩( )和吡咯(
)和吡咯( )形成配位化合物。噻吩、吡咯是类似于苯的芳香化合物,环中的五个原子形成了大
)形成配位化合物。噻吩、吡咯是类似于苯的芳香化合物,环中的五个原子形成了大 键。噻吩难溶于水,吡咯能溶于水,原因是吡咯能与水形成分子间
键。噻吩难溶于水,吡咯能溶于水,原因是吡咯能与水形成分子间②一个立方体结构的
 晶胞如图所示,已知阿伏加德罗数值为
晶胞如图所示,已知阿伏加德罗数值为 ,
, 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-04-28更新
|
810次组卷
|
2卷引用:湖南省衡阳市第一中学2023届高三下学期5月月考化学试题




