名校
解题方法
1 . La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: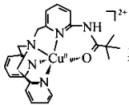 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
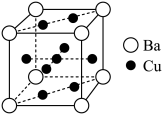
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
2021-09-10更新
|
107次组卷
|
2卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
解题方法
2 . 钛被称为继铁、铝之后的第三金属。钙钛矿是一类氧化物陶瓷材料,典型代表是 晶体,是工业获取钛的重要原料。
晶体,是工业获取钛的重要原料。
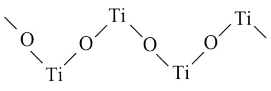
(1)基态钛原子的价层电子排布式为______ ,其原子核外共有______ 种运动状态不同的电子。
(2)六氟合钛酸钾(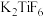 )中存在
)中存在 配离子,其中钛元素的化合价是
配离子,其中钛元素的化合价是______ ,配体是______ 。
(3)硫酸氧钛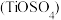 晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为
晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为______ ,阴离子中心原子的杂化轨道类型为______ 。
(4) 晶体结构如图,已知该晶体晶胞参数为anm,则与
晶体结构如图,已知该晶体晶胞参数为anm,则与 紧邻的O个数为
紧邻的O个数为______ ,O与O间的最短距离为______  。
。
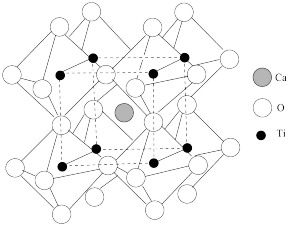
(5)钨青铜( )是一类色彩丰富的非整比化合物,其晶体结构与上述
)是一类色彩丰富的非整比化合物,其晶体结构与上述 晶体结构相同,若
晶体结构相同,若 无空缺,化学式为
无空缺,化学式为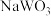 ,完全空缺则为
,完全空缺则为 ,每填入1个
,每填入1个 ,相应有1个
,相应有1个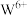 还原为
还原为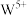 。
。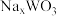 的颜色与x值的对应关系如图所示,已知某钨青铜晶体中
的颜色与x值的对应关系如图所示,已知某钨青铜晶体中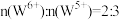 ,则其颜色为
,则其颜色为______ 色。
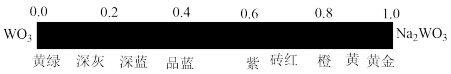
 晶体,是工业获取钛的重要原料。
晶体,是工业获取钛的重要原料。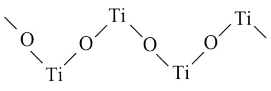
(1)基态钛原子的价层电子排布式为
(2)六氟合钛酸钾(
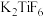 )中存在
)中存在 配离子,其中钛元素的化合价是
配离子,其中钛元素的化合价是(3)硫酸氧钛
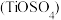 晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为
晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为(4)
 晶体结构如图,已知该晶体晶胞参数为anm,则与
晶体结构如图,已知该晶体晶胞参数为anm,则与 紧邻的O个数为
紧邻的O个数为 。
。
(5)钨青铜(
 )是一类色彩丰富的非整比化合物,其晶体结构与上述
)是一类色彩丰富的非整比化合物,其晶体结构与上述 晶体结构相同,若
晶体结构相同,若 无空缺,化学式为
无空缺,化学式为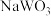 ,完全空缺则为
,完全空缺则为 ,每填入1个
,每填入1个 ,相应有1个
,相应有1个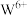 还原为
还原为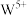 。
。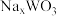 的颜色与x值的对应关系如图所示,已知某钨青铜晶体中
的颜色与x值的对应关系如图所示,已知某钨青铜晶体中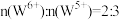 ,则其颜色为
,则其颜色为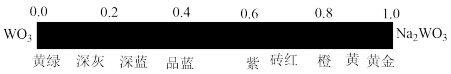
您最近一年使用:0次
名校
3 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤素元素位于元素周期表的___________ 区,溴原子的原子核外有___________ 种不同运动状态的电子,其M能层电子排布式为___________ 。
(2) 中心原子的杂化类型为
中心原子的杂化类型为___________ , 的空间构型为
的空间构型为___________ 。
(3)一定条件下 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)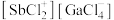 或(b)
或(b)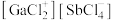 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(4)在离子晶体中,当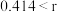 (阳离子)
(阳离子)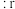 (阴离子)
(阴离子)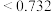 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ 。
a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为 ,高为
,高为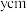 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为___________ 列出计算式。
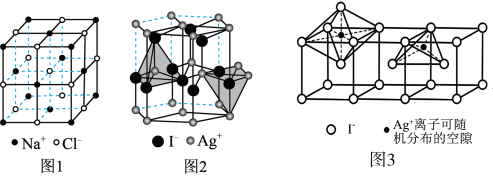
(5)当温度处于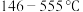 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=___________ 。
(1)卤素元素位于元素周期表的
(2)
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为(3)一定条件下
 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)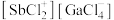 或(b)
或(b)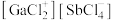 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(4)在离子晶体中,当
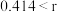 (阳离子)
(阳离子)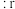 (阴离子)
(阴离子)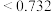 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为
 ,高为
,高为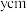 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为
(5)当温度处于
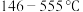 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=
您最近一年使用:0次
解题方法
4 . “中国紫”——硅酸铜钡( ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:
(1)基态Ba原子的价电子排布式为_______ 。
(2) 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。
① 属于
属于_______ 晶体,在 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
②1mol 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为_______ 。
(3) 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。
①氨水中存在的化学键有_______ (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
② 中配体是
中配体是_______ ,所含元素中电负性最小的非金属元素是_______ (填元素符号)。
(4) 的熔点比
的熔点比 的
的_______ (填“高”或“低”),原因是_______ 。
(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
_______ (列出计算式) 。
。
 ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:(1)基态Ba原子的价电子排布式为
(2)
 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。①
 属于
属于 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为 的空间构型为
的空间构型为②1mol
 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为(3)
 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。①氨水中存在的化学键有
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②
 中配体是
中配体是(4)
 的熔点比
的熔点比 的
的(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设
 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
 。
。
您最近一年使用:0次
5 . 氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:___________ 。
②固态氯化钠通常以晶体形式存在。氯化钠晶胞为立方体,结构如图所示:
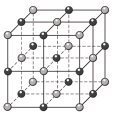
可知每个氯离子周围等距分布着_______ 个钠离子。常温下氯化钠晶体的密度为ρg/cm³,摩尔质量为Mg/mol,则相邻两个Na+之间的距离为_______ cm(用含有ρ和M的代数式表示,阿伏加德罗常数为NA)
③海水晒制的粗盐中常含可溶的硫酸盐杂质。检验精盐中SO42-是否除净的原理是:__________ (用离子方程式表示)
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是___________ (选填字母序号)。
a.着色剂 b.防腐剂 c.营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发生了___________ (填“盐析”或“变性”)。
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是___________ 。
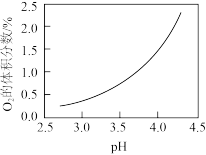
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:___________ 。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:
②固态氯化钠通常以晶体形式存在。氯化钠晶胞为立方体,结构如图所示:

可知每个氯离子周围等距分布着
③海水晒制的粗盐中常含可溶的硫酸盐杂质。检验精盐中SO42-是否除净的原理是:
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是
a.着色剂 b.防腐剂 c.营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发生了
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:

您最近一年使用:0次
解题方法
6 . 列表总结液晶、纳米材料、超分子和等离子体的相关内容
| 聚集状态 | 宏观或微观特征及性质 | 举例和用途 |
| 液晶 | ||
| 纳米材料 | ||
| 超分子 | ||
| 等离子体 |
您最近一年使用:0次
7 . 列表比较晶体和非晶体的区别。
聚集状态 | 微观特征 | 宏观性质 | 举例和用途 |
晶体 | |||
非晶体 |
您最近一年使用:0次
解题方法
8 . 钛在许多领域都有重要用途,因为可以制造人类关节和接骨,被称为“生物金属”。请回答下列问题:
(1)钛在元素周期表中位于第_______ 周期第_______ 族,其基态原子核外电子排布式为_______ 。
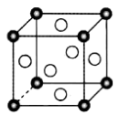
(2)某种钛氧化物晶体的晶胞如图,该晶体每个晶胞中的钛、氧原子个数比为_______ 。

(3)一种铜金合金晶胞如图所示( 原子位于顶角,
原子位于顶角, 原子位于面上),则该合金中
原子位于面上),则该合金中 原子与
原子与 原子个数之比为
原子个数之比为_______ ,若该晶胞的边长为 ,则合金的密度为
,则合金的密度为_______  (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
(1)钛在元素周期表中位于第
(2)某种钛氧化物晶体的晶胞如图,该晶体每个晶胞中的钛、氧原子个数比为

(3)一种铜金合金晶胞如图所示(
 原子位于顶角,
原子位于顶角, 原子位于面上),则该合金中
原子位于面上),则该合金中 原子与
原子与 原子个数之比为
原子个数之比为 ,则合金的密度为
,则合金的密度为 (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
9 . 元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
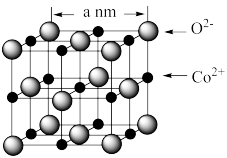
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
10 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的核外电子排布式为___________ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为___________ ;
②EDTA中键角∠NCC___________ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为___________ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是___________ 。
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
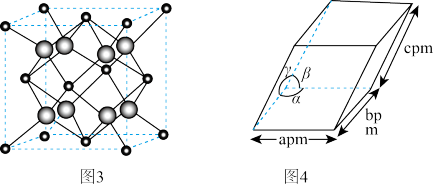
①ZrO2立方晶相中Zr处于O围成的___________ 空隙中。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为___________ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的核外电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中Zr处于O围成的
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次



