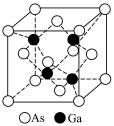
1 . 砷化镓可用作半导体材料,其晶胞结构如题所示;铋( )熔点为271.3℃,铋酸钠(
)熔点为271.3℃,铋酸钠( )不溶于水,有强氧化性,能与
)不溶于水,有强氧化性,能与 反应生成
反应生成 和
和 。下列物质性质与用途具有对应关系的是
。下列物质性质与用途具有对应关系的是
 )熔点为271.3℃,铋酸钠(
)熔点为271.3℃,铋酸钠( )不溶于水,有强氧化性,能与
)不溶于水,有强氧化性,能与 反应生成
反应生成 和
和 。下列物质性质与用途具有对应关系的是
。下列物质性质与用途具有对应关系的是
| A.液氨具有还原性,可用作制冷剂 | B. 能与碱反应,可用作干燥剂 能与碱反应,可用作干燥剂 |
| C.铋熔点低,可制成合金用作电器保险丝 | D.砷化镓硬度大,可用作半导体材料 |
您最近一年使用:0次
2 . 物质的性质决定用途。下列两者具有对应关系的是
| A.NH3易溶于水,可用作制冷剂 |
| B.SO2具有氧化性,可作葡萄酒抗氧化剂 |
| C.离子液体具有良好的导电性,常用作电化学研究的电解质,开发新型电池 |
| D.FeCl3溶液呈酸性,可作为覆铜板制作印刷电路板的腐蚀液 |
您最近一年使用:0次
名校
3 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
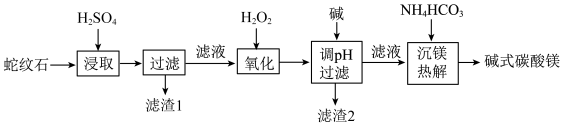
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
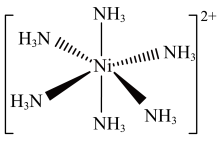
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
227次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高三上学期高考适应性月考卷(六)理科综合试卷
名校
解题方法
4 . 2023年8月1日起,我国对镓(Ga)、锗(Ge)相关物质实施出口管制。镓、锗元素及其化合物有许多用途。请回答:
(1)基态锗(Ge)原子简化的核外电子排布式为______ 。
(2)Ga属于ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
GaF3熔点比GaCl3熔点高很多的原因是________ 。
②比较GaCl3、GeCl4的键角:Cl-Ga-Cl____ Cl-Ge-Cl(填“>”、“<”或“=”)。
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态:________ [用罗马字符标明Ga在化合物中的价态:如Ga(Ⅲ)Cl3]。
(3)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如 2所示。请回答:______ pm(用含a、b的式子表示)。
②请在图2中将沿晶胞对角线A→B方向的As原子所在的位置涂黑________ 。
(1)基态锗(Ge)原子简化的核外电子排布式为
(2)Ga属于ⅢA族元素,可形成GaX3、GaX(X代表卤素原子)两类卤化物和实验式为GaX2的化合物,相邻元素Ge常见卤化物为GeX4。
①金属镓(Ga)的几种卤化物熔点如下表:
| GaF3 | GaCl3 | GaBr3 | |
| 熔点/℃ | >1000 | 77.8 | 122.3 |
②比较GaCl3、GeCl4的键角:Cl-Ga-Cl
③资料显示:Ga不存在+Ⅳ价,请用化学式表示实验式为GaCl2化合物可能的组成形态:
(3)砷化镓是一种重要的半导体材料。砷化镓的晶胞如图1所示,Ga原子做面心立方密堆积,As原子填充在一半由Ga原子构成的四面体空隙中。沿晶胞对角线A→B方向观察得到的投影图如 2所示。请回答:

②请在图2中将沿晶胞对角线A→B方向的As原子所在的位置涂黑
您最近一年使用:0次
解题方法
5 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(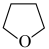 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: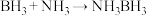 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
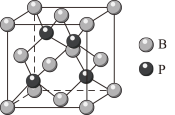
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: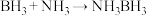 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
6 . 铝镍合金粉经活化处理制得的雷尼镍触媒是一种高活性催化剂,主要应用于催化加氢、有机合成等生产过程。经反复使用后,其活性逐渐降低,失活后变成废镍催化剂,该废镍催化剂的原料组成见下表:
工业上对该催化剂进行处理并回收Al和Ni.工艺流程如下,请回答下列问题:
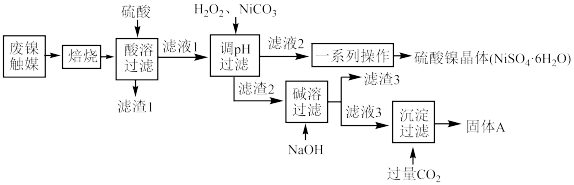
(1)焙烧的目的是___________ 。
(2)请任写一条“滤渣1”在工业上的用途:___________ 。
(3)调pH之前先加入 的目的是
的目的是___________ 。“滤液3”与过量 发生的离子方程式为
发生的离子方程式为___________ 。
(4)“一系列操作”是___________ 。
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量___________ (填试剂名称),过滤,可以分离两种元素。
(6)氧化镍(NiO)是一种重要的半导体材料,其晶体结构与NaCl相同,其中每个镍离子周围有___________ 个最近的氧离子, 与最近的
与最近的 核间距离为anm,则NiO晶体的密度是
核间距离为anm,则NiO晶体的密度是___________  (写出表达式即可)。
(写出表达式即可)。
| 名称 | 有机物 | Ni | Al | Fe | Cu |  |
| 质量分数/% | 13.5 | 40.2 | 36.3 | 2.7 | 1.3 | 6 |

(1)焙烧的目的是
(2)请任写一条“滤渣1”在工业上的用途:
(3)调pH之前先加入
 的目的是
的目的是 发生的离子方程式为
发生的离子方程式为(4)“一系列操作”是
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量
(6)氧化镍(NiO)是一种重要的半导体材料,其晶体结构与NaCl相同,其中每个镍离子周围有
 与最近的
与最近的 核间距离为anm,则NiO晶体的密度是
核间距离为anm,则NiO晶体的密度是 (写出表达式即可)。
(写出表达式即可)。
您最近一年使用:0次
解题方法
7 . 氟是电负性最大的元素,人体中存在于牙齿和骨头中,自然界中主要以萤石、冰晶石和氟磷灰石存在。回答下列问题:
(1)基态氟原子的核外电子有_______ 种空间运动状态,基态氟离子的价电子排布图为_______ 。
(2)牙齿的主要成分是 (羟基磷酸钙),人进食后,细菌和酶作用于食物产生有机酸,此时牙齿会受到腐蚀,向牙膏中添加
(羟基磷酸钙),人进食后,细菌和酶作用于食物产生有机酸,此时牙齿会受到腐蚀,向牙膏中添加 、
、 均可增强护齿效果。下列有关说法不正确的是_______。
均可增强护齿效果。下列有关说法不正确的是_______。
(3)萤石的主要成分是 ,其重要用途之一是生产氢氟酸。
,其重要用途之一是生产氢氟酸。
①氢氟酸溶液存在的氢键有_______ 种。
②氢氟酸常用来蚀刻玻璃: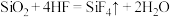 ,从原子结构和反应原理的角度分析该反应能发生的原因
,从原子结构和反应原理的角度分析该反应能发生的原因_______
(4)冰晶石(化学式为 )的结构单元如图所示,已知冰晶石熔融时的电离方程式为
)的结构单元如图所示,已知冰晶石熔融时的电离方程式为 。●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,则大立方体的体心处,▽所代表的微粒是
。●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,则大立方体的体心处,▽所代表的微粒是_______ 。 B.
B. C.
C. D.
D.
已知晶胞参数为 ,则冰晶石的密度是
,则冰晶石的密度是_______  (用含
(用含 、
、 的式子表示)。
的式子表示)。
(1)基态氟原子的核外电子有
(2)牙齿的主要成分是
 (羟基磷酸钙),人进食后,细菌和酶作用于食物产生有机酸,此时牙齿会受到腐蚀,向牙膏中添加
(羟基磷酸钙),人进食后,细菌和酶作用于食物产生有机酸,此时牙齿会受到腐蚀,向牙膏中添加 、
、 均可增强护齿效果。下列有关说法不正确的是_______。
均可增强护齿效果。下列有关说法不正确的是_______。A. 中非金属元素的原子半径和电负性最大的是氧 中非金属元素的原子半径和电负性最大的是氧 |
B. 中的中心P原子采用 中的中心P原子采用 杂化,空间构型为正四面体 杂化,空间构型为正四面体 |
C. 碳酸氢钠晶体中阴阳离子总数为 碳酸氢钠晶体中阴阳离子总数为 |
D.向牙膏中添加 、 、 均可增强护齿效果,两者原理相同 均可增强护齿效果,两者原理相同 |
(3)萤石的主要成分是
 ,其重要用途之一是生产氢氟酸。
,其重要用途之一是生产氢氟酸。①氢氟酸溶液存在的氢键有
②氢氟酸常用来蚀刻玻璃:
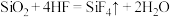 ,从原子结构和反应原理的角度分析该反应能发生的原因
,从原子结构和反应原理的角度分析该反应能发生的原因(4)冰晶石(化学式为
 )的结构单元如图所示,已知冰晶石熔融时的电离方程式为
)的结构单元如图所示,已知冰晶石熔融时的电离方程式为 。●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,则大立方体的体心处,▽所代表的微粒是
。●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,则大立方体的体心处,▽所代表的微粒是
 B.
B. C.
C. D.
D.
已知晶胞参数为
 ,则冰晶石的密度是
,则冰晶石的密度是 (用含
(用含 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
8 . 硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 种。CH3As(OH)2与(CH3)2AsOH两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为( ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。___________ 。
②m=_________
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为___________ nm(列出计算式)。
(4)FeSO4·7H2O的结构如图所示。___________ (填序号)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.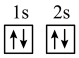 B.
B.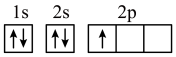
C. D.
D.
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为(
 ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
②m=
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为
(4)FeSO4·7H2O的结构如图所示。

您最近一年使用:0次
2023-12-27更新
|
556次组卷
|
3卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
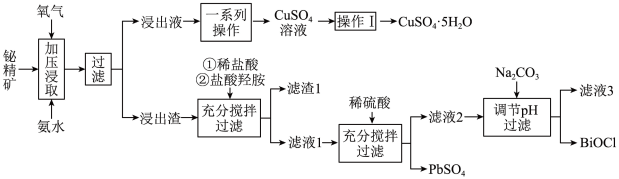
9 . 铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备BiOCl的一种方法,其流程如图:
① 开始沉淀
开始沉淀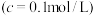 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。
② 开始沉淀
开始沉淀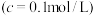 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。
③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(2)“操作I”为___________ 。基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是___________ (至少答一点)。
(4)滤液3中 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为___________ 。
(5)写出流程中生成BiOCl的离子方程式:___________ 。
(6)铋化锂晶胞结构如图所示: ,B为
,B为___________ 。
②若晶胞的参数为apm,阿伏加德罗常数为 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
①
 开始沉淀
开始沉淀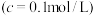 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。②
 开始沉淀
开始沉淀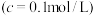 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(2)“操作I”为
 的价层电子轨道表示式是
的价层电子轨道表示式是(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是
(4)滤液3中
 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为(5)写出流程中生成BiOCl的离子方程式:
(6)铋化锂晶胞结构如图所示:
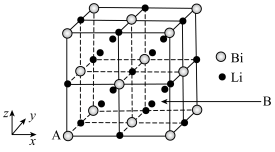
 ,B为
,B为②若晶胞的参数为apm,阿伏加德罗常数为
 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . VA族氮、磷、砷(As)、锑(Sb)元素及其化合物应用广泛。 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄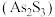 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄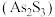 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是A. 是由极性键形成的极性分子 是由极性键形成的极性分子 |
| B.P4是正四面体形分子,其中P-P-P夹角为60° |
| C.VA族元素单质的晶体类型相同 |
D.基态砷原子(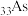 )核外价电子排布式为 )核外价电子排布式为 |
您最近一年使用:0次



