1 . 碳元素能构成石墨、甲醛、碳化硅、甲醇、甲酸等多种工业原料。下列物质结构与性质或用途具有对应关系的是
| A.石墨晶体的层状结构间存在分子间作用力,具有导电性 |
| B.甲醛能溶于水,可用于制备酚醛树脂 |
| C.SiC中原子以共价键形成空间网状结构,可作砂轮的磨料 |
D. 离子间能形成氢键,所以HCOONa熔点比 离子间能形成氢键,所以HCOONa熔点比 高 高 |
您最近一年使用:0次
2024-06-04更新
|
110次组卷
|
2卷引用:2024届贵州省贵阳市第一中学高三下学期三模化学试题
2 . 下列物质结构与性质或物质性质与用途对应关系不正确的是
A. 与 与 均属于非极性分子,可用 均属于非极性分子,可用 萃取碘水中的 萃取碘水中的 |
| B.石墨晶体的层状结构间存在分子间作用力,可作为导电电极 |
| C.葡萄糖具有还原性,能发生银镜反应,可用于工业制镜 |
| D.SiC中原子以共价键形成空间网状结构,可作砂轮的磨料 |
您最近一年使用:0次
解题方法
3 . 以大洋锰结核(主要由MnO2和铁氧化物组成,还含有Al、Mg、Zn、Ca、Si等元素)为原料,制备MnxOy及Mn(H2PO4)2·2H2O,所得产品具有广泛的用途。制备过程如下图所示:
②25℃时,Ksp(ZnS)=2.9×10-25;Ksp(MnF2)=5.3×10-3;Ksp(MgF2)=7.4×10-11;Ksp(MnCO3)=1.0×10-11。
1.“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式_______ 。
2.温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度_______。
3.“调pH”时,应控制的pH范围是_______ 。“净化”后滤渣3的主要成分_______ 。
4.“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为_______ 。若改用加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)  Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = _______ (填数值)。
5.要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为_______ 、过滤、洗涤、干燥。
“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
6.晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。其的分子式为_______ ;若阿伏加德罗常数为NA mol-1,则晶体Ⅰ的密度为_______ g·cm-3。

| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
1.“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式
2.温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度_______。

| A.45度 | B.90度 | C.120度 | D.135度 |
4.“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为
 Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = 5.要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为
“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
6.晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。其的分子式为

您最近一年使用:0次
名校
4 . 氮、磷化合物在科研和生产中有许多重要用途。回答下列问题:
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为_________ ,H、B、N的电负性由大到小的顺序为____ 。与氨硼烷互为等电子体的分子是_______ (写名称),其熔点比NH3BH3低,原因是__________ 。
(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状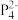 结构与苯相似,
结构与苯相似,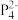 中的大π键可表示为
中的大π键可表示为___________ 。
___ 种,TiO2晶胞的密度为_________ g/cm3,TiO2-aNb 晶体中a:b=_________ 。
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H
 +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状
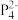 结构与苯相似,
结构与苯相似,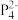 中的大π键可表示为
中的大π键可表示为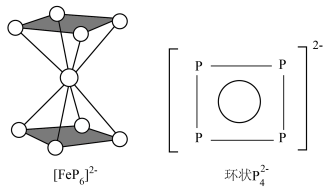
您最近一年使用:0次
名校
解题方法
5 . 过渡元素在现代工农业生产和科技发展方面具有重要的用途。回答下列问题:
(1)已知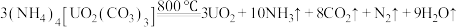 。
。
①基态N原子的核外电子中自旋状态相反的电子数之比为___________ 。
②反应中断裂的化学键有___________ (填标号)。
a.氢键 b.极性键 c.非极性键 d.离子键
③反应所得的气态产物中属于非极性分子的是___________ (填化学式,下同);氢化物中更易与 形成配离子的是
形成配离子的是___________ 。向 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出得到深蓝色溶液反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出得到深蓝色溶液反应的离子方程式___________ 。
(2)Ti的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,原因是
熔点高于其他三种卤化物,原因是___________ 。
(3)铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为anm。___________ 。
②已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为___________  。
。
(1)已知
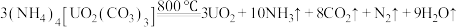 。
。①基态N原子的核外电子中自旋状态相反的电子数之比为
②反应中断裂的化学键有
a.氢键 b.极性键 c.非极性键 d.离子键
③反应所得的气态产物中属于非极性分子的是
 形成配离子的是
形成配离子的是 溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出得到深蓝色溶液反应的离子方程式
溶液中滴加少量氨水,产生蓝色沉淀,继续滴加氨水可得到深蓝色透明溶液,写出得到深蓝色溶液反应的离子方程式(2)Ti的四卤化物熔点如下表所示,
 熔点高于其他三种卤化物,原因是
熔点高于其他三种卤化物,原因是| 化合物 |  |  |  |  |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为anm。

②已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为 。
。
您最近一年使用:0次
名校
解题方法
6 . 钛被视为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”,钛和钛的化合物在航天、化工、建筑、医疗中都有着广泛的用途。回答下列问题:
(1)①钛原子在元素周期表中的位置是___________ , 的电子排布式为
的电子排布式为___________ 。
② 能形成
能形成 ,该物质中,配位原子的杂化类型是
,该物质中,配位原子的杂化类型是___________ , 该物质含有
该物质含有___________ mol 键。
键。
(2)钛与卤素形成的化合物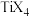 熔点如下表,它们熔点差异的原因是
熔点如下表,它们熔点差异的原因是___________ 。
(3)有一种氮化钛晶体的晶胞与 晶胞相似,该晶体的晶胞参数为
晶胞相似,该晶体的晶胞参数为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为___________  (只列式,不计算,
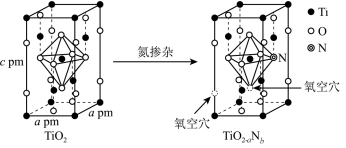
(只列式,不计算, 为阿伏加德罗常数的值),用Al掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的Al有
为阿伏加德罗常数的值),用Al掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的Al有___________ 个。
(1)①钛原子在元素周期表中的位置是
 的电子排布式为
的电子排布式为②
 能形成
能形成 ,该物质中,配位原子的杂化类型是
,该物质中,配位原子的杂化类型是 该物质含有
该物质含有 键。
键。(2)钛与卤素形成的化合物
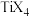 熔点如下表,它们熔点差异的原因是
熔点如下表,它们熔点差异的原因是 |  |  |  |  |
| 熔点/℃ | 377 |  | 38.3 | 153 |
(3)有一种氮化钛晶体的晶胞与
 晶胞相似,该晶体的晶胞参数为
晶胞相似,该晶体的晶胞参数为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为 (只列式,不计算,
(只列式,不计算, 为阿伏加德罗常数的值),用Al掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的Al有
为阿伏加德罗常数的值),用Al掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的Al有
您最近一年使用:0次
7 . 某工厂废渣的主要成分为ZnO、PbO、 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是___________ (填分子式),该气体的用途是___________ (填一条)。
(2)“氨浸”所得滤液1中的阳离子主要成分为 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是___________ ,“沉铜”时发生反应的离子方程式为___________ 。
(3)“滤渣4”的主要成分为___________ (填化学式)。
(4)“滤液3”的主要溶质为 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为___________ 。
(5)“转化”时生成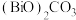 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为___________ 。
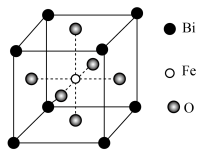
(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。___________ 。
②该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是
(2)“氨浸”所得滤液1中的阳离子主要成分为
 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是(3)“滤渣4”的主要成分为
(4)“滤液3”的主要溶质为
 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为(5)“转化”时生成
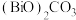 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。
②该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
8 . 我国科学家以二氧化碳为原料,通过全合成方法成功制得了淀粉,取得了科技领域的一个重大突破。以 为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原
为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原 的过程中可同时发生反应①②。
的过程中可同时发生反应①②。
①
②
(1)
___________ 。
(2)已知 时,反应能自发进行反应,反应①的
时,反应能自发进行反应,反应①的 ,则反应①自发进行的温度不超过
,则反应①自发进行的温度不超过___________ K(保留一位小数)。
(3)在恒温恒容密闭容器中,充入一定量的 及
及 ,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
已知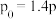 ,则表中
,则表中
___________ ;反应①的平衡常数
___________ 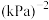 (用含p的代数式表示),
(用含p的代数式表示), 为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
(4)向恒压反应器中通入 和
和 ,
, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化的关系如图所示。已知:
的平衡产率随温度变化的关系如图所示。已知: 的产率
的产率 。
。 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
(5) 的综合利用有利于“碳中和”,
的综合利用有利于“碳中和”, 分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为___________ ,晶体的密度
___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数)。
为阿伏加德罗常数)。 的用途广泛,请写出一种与其物理性质相关的用途:
的用途广泛,请写出一种与其物理性质相关的用途:___________ 。
 为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原
为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原 的过程中可同时发生反应①②。
的过程中可同时发生反应①②。①

②

(1)

(2)已知
 时,反应能自发进行反应,反应①的
时,反应能自发进行反应,反应①的 ,则反应①自发进行的温度不超过
,则反应①自发进行的温度不超过(3)在恒温恒容密闭容器中,充入一定量的
 及
及 ,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:| n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(CO)/mol | n(H2O)/mol | 总压/ | |
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | m | 0.3 | p |
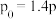 ,则表中
,则表中

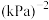 (用含p的代数式表示),
(用含p的代数式表示), 为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。(4)向恒压反应器中通入
 和
和 ,
, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化的关系如图所示。已知:
的平衡产率随温度变化的关系如图所示。已知: 的产率
的产率 。
。
 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是(5)
 的综合利用有利于“碳中和”,
的综合利用有利于“碳中和”, 分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数)。
为阿伏加德罗常数)。
 的用途广泛,请写出一种与其物理性质相关的用途:
的用途广泛,请写出一种与其物理性质相关的用途:
您最近一年使用:0次
解题方法
9 . 氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,形成的化合物有:N2F2、HBF4、 等。回答下列问题:
等。回答下列问题:
(1)氟元素基态原子最高能级电子的电子云形状为___________ ,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的___________ (填“长”或“短”)。___________ ,设NA为阿伏加德罗常数的值则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
 等。回答下列问题:
等。回答下列问题:(1)氟元素基态原子最高能级电子的电子云形状为
A.1s22s22p43s1 B.1s22s22p6 C.1s22s22p5 D.1s22s12p6
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
 键与
键与 键的数目之比为
键的数目之比为(3)氟硼酸(HBF4,属于强酸)可由HF和BF3化合生成,常用于替代浓硫酸作铅蓄电池的电解质溶液,从化学键形成角度分析HF与BF3能化合的原因
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物
 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中C-C键的键长比石墨中C-C键的
中C-C键的键长比石墨中C-C键的
 (列出计算式)。
(列出计算式)。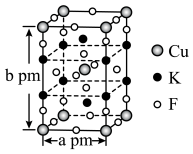
您最近一年使用:0次
10 . 硼、砷、镓等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)
(2)同周期中第一电离能大于砷的元素有___________ 种。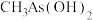 与
与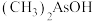 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)氮( )、镓(
)、镓( )合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被
)合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。
原子代替。
①以下说法错误的是___________ (填字母)。 晶体中存在非极性共价键 B.电负性:
晶体中存在非极性共价键 B.电负性:
C.原子半径: D.沸点:
D.沸点:
②晶胞中与同一个 原子相连的
原子相连的 原子构成的空间构型为
原子构成的空间构型为___________ ,晶胞中与 原子相邻且最近的
原子相邻且最近的 原子个数为
原子个数为___________ 。
③若 晶胞边长为
晶胞边长为 ,则
,则 原子与
原子与 原子的最短核间距为
原子的最短核间距为___________ pm。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号)
A.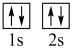 | B.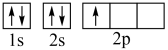 |
C.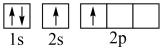 | D.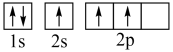 |
(2)同周期中第一电离能大于砷的元素有
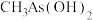 与
与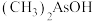 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是(3)氮(
 )、镓(
)、镓( )合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被
)合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。
原子代替。①以下说法错误的是

 晶体中存在非极性共价键 B.电负性:
晶体中存在非极性共价键 B.电负性:
C.原子半径:
 D.沸点:
D.沸点:
②晶胞中与同一个
 原子相连的
原子相连的 原子构成的空间构型为
原子构成的空间构型为 原子相邻且最近的
原子相邻且最近的 原子个数为
原子个数为③若
 晶胞边长为
晶胞边长为 ,则
,则 原子与
原子与 原子的最短核间距为
原子的最短核间距为
您最近一年使用:0次



