名校
解题方法
1 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应得到BF3和BN,如图所示。下列叙述正确的是
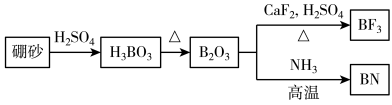
| A.硼酸具有片层状结构,层与层之间、H3BO3单元间都仅以范德华力连接 |
| B. NH3与BF3都是由极性键构成的极性分子 |
C. 与HF反应后再用氨气中和得到 与HF反应后再用氨气中和得到 ,1 mol ,1 mol 含有配位键的数目为 含有配位键的数目为 |
| D.立方氮化硼结构与金刚石相似,立方氮化硼晶胞中每个氮原子周围有4个硼原子 |
您最近一年使用:0次
2023-05-13更新
|
211次组卷
|
3卷引用:河南省安阳市新乡鹤壁2022-2023学年高二下学期5月份联考化学试题
解题方法
2 . 下列说法中正确的是
A.60g 中含Si-O键的个数为 中含Si-O键的个数为 |
B.124g 含有的P-P键的个数为 含有的P-P键的个数为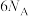 |
C.12g石墨中含有的C-C键的个数为 |
D.12g金刚石中含有的C-C键的个数为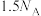 |
您最近一年使用:0次
3 . 如图是金刚石晶体结构模型,下列关于金刚石的说法正确的是

| A.金刚石晶体中碳碳键之间的夹角为120° |
| B.金刚石晶胞中六元环中的碳原子在同一平面内 |
| C.每个碳原子与其他4个碳原子相连形成正四面体结构 |
| D.金刚石晶体中碳原子与碳碳键数目之比为1:4 |
您最近一年使用:0次
4 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
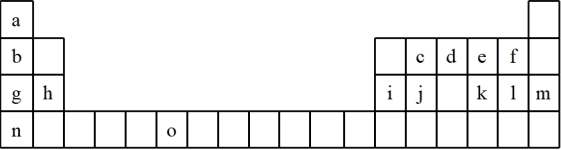
(1)请写出元素“o”的基态原子的价电子排布式_______ 。
(2)k在空气中燃烧产物的分子构型为_______ ,中心原子的杂化形式为_______ ,该分子是_______ (填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)_______ ,试从结构角度加以解释_______ 。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为_______ 。
②该晶体的密度为_______ g/cm3。

(1)请写出元素“o”的基态原子的价电子排布式
(2)k在空气中燃烧产物的分子构型为
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为
②该晶体的密度为
您最近一年使用:0次
解题方法
5 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
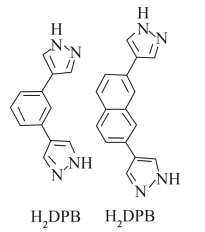
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
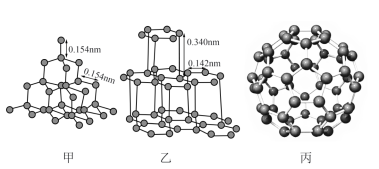
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
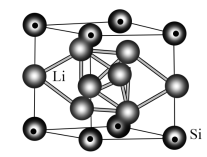
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
6 . 下列化合物,按其晶体的熔点由高到低排列正确的是
| A.CsCl、KCl、NaCl | B.SiCl4、SiF4、SiH4 |
| C.H2Se、H2S、H2O | D.晶体硅、碳化硅、金刚石 |
您最近一年使用:0次
2022-05-29更新
|
173次组卷
|
3卷引用:河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期5月月考化学试题
解题方法
7 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
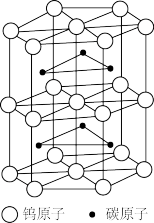
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
2022-05-27更新
|
409次组卷
|
5卷引用:河南省2022届高三下学期仿真模拟大联考理科综合化学试题
河南省2022届高三下学期仿真模拟大联考理科综合化学试题河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
8 . 下列物质性质与用途不相应的是
| A.SO2具有漂白性,可用于纸浆漂白 |
| B.石墨具有良好的润滑性,可用作电池电极材料 |
| C.液氮的沸点较低,可为超导材料提供低温环境 |
| D.硫酸钡难溶于酸,可作为“胃镜”检查中的内服药剂 |
您最近一年使用:0次
9 . 下列各组物质的晶体类型相同,物质发生状态变化所克服的相互作用也相同的是
| A.SO2和HCl | B.KCl和Mg | C.CCl4和SiO2 | D.NaCl和H2O |
您最近一年使用:0次
2022-04-21更新
|
123次组卷
|
7卷引用:河南省郑州市十校2021-2022学年高二下学期期中联考化学试题
河南省郑州市十校2021-2022学年高二下学期期中联考化学试题(已下线)2010—2011学年浙江省杭州二中高一下学期期中考试化学试卷江苏宿迁泗阳县众兴中学2021届高三上学期调研考试化学试题(已下线)第38讲 晶体结构与性质(精讲)-2022年一轮复习讲练测(已下线)专题4.3.2 共价键(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)江苏省苏州市相城区陆慕高级中学2021-2022学年高二下学期第一次月考化学试题黑龙江省绥化市第九中学2021-2022学年高二下学期期末考试化学试题
名校
10 . 设NA为阿伏加德罗常数的值。下列说法不正确的是
| A.12g金刚石中含有C-C的个数为2NA |
| B.124g白磷(P4)晶体中含有P-P的个数为6NA |
| C.18g冰中含有氢键的个数为4NA |
| D.SiO2晶体中1mol硅原子可与氧原子形成4NA个共价键(Si-O) |
您最近一年使用:0次
2022-03-19更新
|
363次组卷
|
5卷引用:河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题



