名校
解题方法
1 . 下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)写出上表中元素⑨的三价离子的结构示意图_______ 。
(2)元素⑩的晶体中原子堆积方式是_______ ,晶体中原子的空间利用率是_______
(3)元素②的第二电离能_______ Na(填写“>”“=”或“<”)的第二电离能;元素⑨的氧化物MXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,若晶体中的M分别为M2﹢、M3﹢,此晶体中M2﹢与M3﹢的最简整数比为_______
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______ 。
(5)用惰性电极电解足量的由元素⑦与元素⑧形成的化合物的水溶液,写出电解反应的离子方程式为_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
(2)元素⑩的晶体中原子堆积方式是
(3)元素②的第二电离能
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是
(5)用惰性电极电解足量的由元素⑦与元素⑧形成的化合物的水溶液,写出电解反应的离子方程式为
您最近一年使用:0次
解题方法
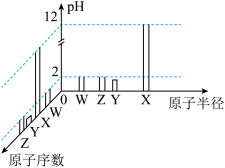
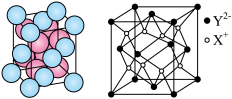
2 . 已知W、X、Y、Z为短周期元素,R外围电子的电子排布式为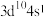 。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为
。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为 )的pH和原子半径、原子序数的关系如图所示。回答下列问题。
)的pH和原子半径、原子序数的关系如图所示。回答下列问题。
(1)R位于元素周期表中第_______ 周期第_______ 族。
(2)写出化合物 的电子式
的电子式_______ 。
(3)基态Z原子中存在未成对电子的能级,画出Z原子该能级的轨道表示式_______ 。
(4)XZ晶体中,其化学键的牢固程度可用_______ 衡量。
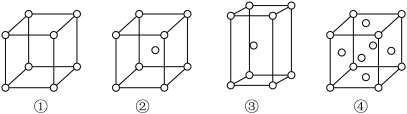
(5)有四种不同堆积方式的金属晶体的晶胞如下图所示,单质R晶体的堆积方式是_______ (填序号),其二维空间的排列方式为_______ (填“非密置层”或“密置层”)。
(6) 的晶胞如下图所示,设
的晶胞如下图所示,设 的半径为
的半径为 ,
, 的半径为
的半径为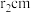 。该晶体中每个
。该晶体中每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 共有
共有_______ 个, 的配位数为
的配位数为_______ 。 晶体的密度为
晶体的密度为_______  。(阿伏加德罗常数的值用
。(阿伏加德罗常数的值用 表示,写表达式,不化简)。
表示,写表达式,不化简)。
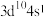 。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为
。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为 )的pH和原子半径、原子序数的关系如图所示。回答下列问题。
)的pH和原子半径、原子序数的关系如图所示。回答下列问题。
(1)R位于元素周期表中第
(2)写出化合物
 的电子式
的电子式(3)基态Z原子中存在未成对电子的能级,画出Z原子该能级的轨道表示式
(4)XZ晶体中,其化学键的牢固程度可用
(5)有四种不同堆积方式的金属晶体的晶胞如下图所示,单质R晶体的堆积方式是

(6)
 的晶胞如下图所示,设
的晶胞如下图所示,设 的半径为
的半径为 ,
, 的半径为
的半径为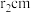 。该晶体中每个
。该晶体中每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 共有
共有 的配位数为
的配位数为 晶体的密度为
晶体的密度为 。(阿伏加德罗常数的值用
。(阿伏加德罗常数的值用 表示,写表达式,不化简)。
表示,写表达式,不化简)。
您最近一年使用:0次
解题方法
3 . 建造中国空间站,化学材料功不可没,如制造空间站外壳用到钛合金,制造太阳翼伸展机构用到碳化硅,制造“天和”核心舱电推进系统用到氮化硼。回答下列问题:
(1)基态N原子的价电子排布图(轨道表示式)为_______
(2)金属钛的晶体属于六方最密堆积,其堆积方式如如图_______ (填“甲”或“乙”),配位数为_______ 。
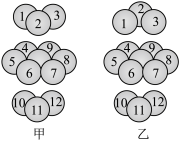
(3)B、C、N第一电离能由小到大的顺序是_______ ,氮的第一电离能大于氧的原因是_______ 。
(4)碳化硅具有硬度大、耐高温、绝缘性能好等优点,则碳化硅所属晶体类型是_______ ,碳化硅的硬度略小于金刚石,其原因是_______ 。
(5)氮化硼的晶体结构有两种:六方氮化硼和立方氮化硼,前者具有石墨型晶体结构,后者晶体结构如图所示。
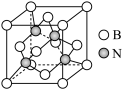
①六方氮化硼晶体中B、N原子的杂化轨道类型均为_______ ,立方氮化硼晶体中B、N原子的杂化轨道类型均为_______ 。
②已知立方氮化硼晶体的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则立方氮化硼的晶胞参数a=
,则立方氮化硼的晶胞参数a=_______ pm(列出计算式)。
(1)基态N原子的价电子排布图(轨道表示式)为
(2)金属钛的晶体属于六方最密堆积,其堆积方式如如图

(3)B、C、N第一电离能由小到大的顺序是
(4)碳化硅具有硬度大、耐高温、绝缘性能好等优点,则碳化硅所属晶体类型是
(5)氮化硼的晶体结构有两种:六方氮化硼和立方氮化硼,前者具有石墨型晶体结构,后者晶体结构如图所示。

①六方氮化硼晶体中B、N原子的杂化轨道类型均为
②已知立方氮化硼晶体的密度为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则立方氮化硼的晶胞参数a=
,则立方氮化硼的晶胞参数a=
您最近一年使用:0次
名校
4 . I.有下列8种晶体,用序号回答下列问题:
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是____ ,属于离子晶体的是____ ,不含化学键的分子晶体是____ 。
(2)由极性分子构成的晶体是____ ,含有共价键的离子晶体是____ 。
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为____ 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____ 。
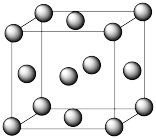
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为_____ 。
III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为_____ ;NO 的空间构型为
的空间构型为_____ (用文字描述)。
(7)与O3分子互为等电子体的一种阴离子为_____ (填化学式)。
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=_____ 。
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是
(2)由极性分子构成的晶体是
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为

III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(7)与O3分子互为等电子体的一种阴离子为
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=
您最近一年使用:0次
5 . 立方晶系二元合金
有一立方晶系二元合金,单胞参数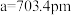 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体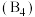 ,已知晶胞中
,已知晶胞中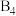 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
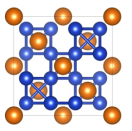
(1)写出二元合金的化学式_______ 。
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度_______ 。
(3)晶胞的单位点阵型式_______ 。
(4)实际上,大部分该类结构二元合金的原子半径比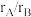 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和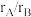 值
值_______ 、_______ 。
有一立方晶系二元合金,单胞参数
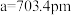 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体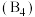 ,已知晶胞中
,已知晶胞中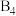 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
(1)写出二元合金的化学式
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度
(3)晶胞的单位点阵型式
(4)实际上,大部分该类结构二元合金的原子半径比
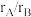 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和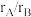 值
值
您最近一年使用:0次
6 . 回答下列问题:
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
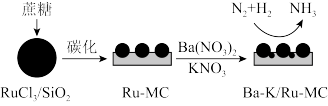
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为____ 。
②一个基态Fe2+和Fe3+未成对电子数之比为____ 。
③NH3的键角____ (填“大于”或“小于”)PH3,其原因为____ 。
④NO 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有___ 。
⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为___ 。
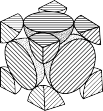
(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为____ ,钴原子的配位数是____ ,若该堆积方式下的晶胞参数为acm,(阿伏加德罗常数为NA),则钴原子的半径为___ pm。
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
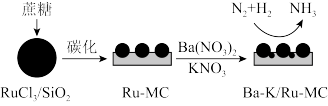
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为
②一个基态Fe2+和Fe3+未成对电子数之比为
③NH3的键角
④NO
 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π
 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为

您最近一年使用:0次
名校
7 . 已知X、Y、Z、W、Q是原子序数依次增大的前四周期元素。X原子核外有6种不同运动状态的电子;Y基态原子中s电子总数与p电子总数相等;Z最高价氧化物对应水化物的碱性在同周期元素中最强;W基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反。
(1)基态X原子中电子占据的最高能级的原子轨道形状为_______ 。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)Y、Z、W的简单离子半径由大到小的顺序为_______ 。(用离子符号表示)
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为_______ 。
②检验溶液中是否含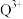 离子的试剂是
离子的试剂是_______ (填化学式),现象为_______ 。
③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_______ (填字母序号)。
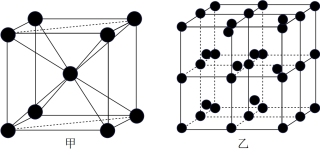
A.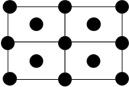 B.
B.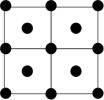 C.
C.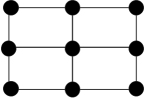 D.
D.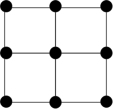
(1)基态X原子中电子占据的最高能级的原子轨道形状为
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为(2)Y、Z、W的简单离子半径由大到小的顺序为
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为
②检验溶液中是否含
 离子的试剂是
离子的试剂是③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是

A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
8 . 磷元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
(2)白磷在空气中缓慢氧化生成P4O6,P4O6的结构如图1所示。P4O6中氧原子的杂化轨道类型为_______ ,每个P4O6分子中含孤电子对的数目为_______ 。
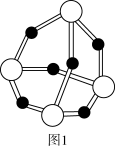
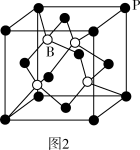
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为_______ ,磷原子的配位数为_______ 。
(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为_______ 。
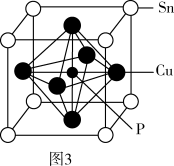
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的_______ 的空隙中。若晶体密度为ag·cm-3,P原子与最近的Cu原子的核间距为_______ nm(用含NA的代数式表示,NA为阿伏加德罗常数的值)。
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
A.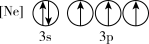 | B.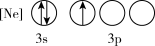 |
C.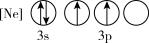 | D.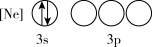 |

(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为

(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
9 . 铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途,如二茂铁可用作火箭燃料添加剂,含铁等磁性材料被广泛应用于电子信息、军事技术等领域。根据题目信息回答下列问题:
(1)基态Fe原子的电子排布式为_______ 。
(2)二茂铁(C5H5)2Fe是一种浅黄色难溶于水的液体,其熔点-20℃,沸点103℃。依据以上信息可推断二茂铁属于_______ (“离子晶体”、“分子晶体”或“原子晶体”)。
(3)独立的NH3分子中,H-N-H键键角为107.3,下图是[Zn(NH3)6]2+离子的部分结构以及其中H-N-H键键角。
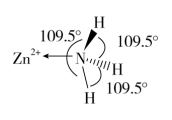
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5的原因是_______ 。
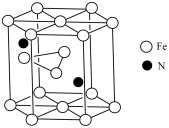
(4)某种磁性氮化铁的结构如下图所示,Fe的堆积方式为_______ ,则该化合物的化学式为_______ ;氮化铁晶胞底边长为a pm,高为b pm,则这种磁性氮化铁的晶体密度为_______ g·cm-3 (用含a、b和NA的计算式表示)。
(1)基态Fe原子的电子排布式为
(2)二茂铁(C5H5)2Fe是一种浅黄色难溶于水的液体,其熔点-20℃,沸点103℃。依据以上信息可推断二茂铁属于
(3)独立的NH3分子中,H-N-H键键角为107.3,下图是[Zn(NH3)6]2+离子的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5的原因是
(4)某种磁性氮化铁的结构如下图所示,Fe的堆积方式为

您最近一年使用:0次
10 . 硼、铝、镓、铟、铊位于元素周期表第ⅢA族,统称为硼族元素,它们的单质及化合物在工农业生产中有着重要的应用。
(1)基态镓原子的外围电子排布式为_______ 。
(2)硼酸晶体具有层状结构,每一层的平面层状结构如图1所示。硼酸分子中B原子采取_______ 杂化;晶体平面层内所含有作用力类型有_______ 。
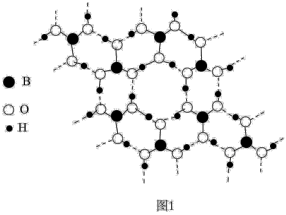
(3)工业上通常用电解法冶炼铝。已知Al2O3熔点为2054℃、AlCl3熔点为194℃,冶炼铝时应选择电解熔融_______ (填化学式),理由是_______ 。
(4)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种离子构成,其中阴离子具有正八面体结构,写出该阴离子的化学式_______ ,与该阴离子互为等电子体的分子有_______ 。
(5)铊具有三种晶体结构:低于230℃时为六方最密堆积(α-Tl),230℃以上转化为体心立方堆积(β-Tl),在高压下形成面心立方最密堆积(γ-Tl),晶胞结构如图2所示。
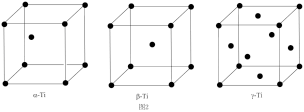
三种铊的晶体中,铊的配位数之比(α:β:γ)为_______ .若铊原子半径为a pm,则β-Tl中铊原子间最短距离为_______ pm (用含a的式子表示,下同),γ-Tl晶体的密度计算式为ρ=_______ g/cm3(设NA为阿伏加德罗常数的值)。
(1)基态镓原子的外围电子排布式为
(2)硼酸晶体具有层状结构,每一层的平面层状结构如图1所示。硼酸分子中B原子采取

(3)工业上通常用电解法冶炼铝。已知Al2O3熔点为2054℃、AlCl3熔点为194℃,冶炼铝时应选择电解熔融
(4)冰晶石(Na3AlF6)是炼铝的助熔剂,由两种离子构成,其中阴离子具有正八面体结构,写出该阴离子的化学式
(5)铊具有三种晶体结构:低于230℃时为六方最密堆积(α-Tl),230℃以上转化为体心立方堆积(β-Tl),在高压下形成面心立方最密堆积(γ-Tl),晶胞结构如图2所示。

三种铊的晶体中,铊的配位数之比(α:β:γ)为
您最近一年使用:0次



