名校
1 . 某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
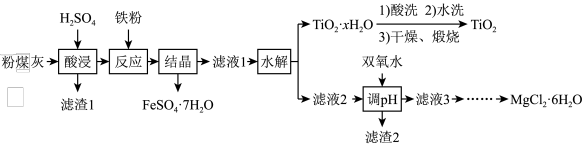
已知:①常温下,Ksp[Al(OH)3] ≈ 8.0×10-35;②滤液1中仍有Fe2+剩余③Fe3+完全沉淀时pH为3.7;Al3+完全沉淀时pH为5.0;Fe2+完全沉淀时pH为9.7;
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_________ (任写两种)。
(2)怎样判断TiO2•xH2O沉淀已经洗涤干净________________________________ 。
(3)加入双氧水的目的是_____________________________________ 。滤渣2中的成分分别为Al(OH)3和_______________ ,Al(OH)3沉淀完全时(溶液中离子浓度小于10-5mol/L),溶液中的c(OH-)为________ 。
(4)将MgCl2•6H2O制成无水MgCl2时应注意__________________________________ 。
(5)某同学以石墨为两个电极,电解MgCl2溶液以制取金属镁。你认为他能否获得成功?_______ 。用化学方程式解释原因___________________________________ 。

已知:①常温下,Ksp[Al(OH)3] ≈ 8.0×10-35;②滤液1中仍有Fe2+剩余③Fe3+完全沉淀时pH为3.7;Al3+完全沉淀时pH为5.0;Fe2+完全沉淀时pH为9.7;
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有
(2)怎样判断TiO2•xH2O沉淀已经洗涤干净
(3)加入双氧水的目的是
(4)将MgCl2•6H2O制成无水MgCl2时应注意
(5)某同学以石墨为两个电极,电解MgCl2溶液以制取金属镁。你认为他能否获得成功?
您最近一年使用:0次
名校
2 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
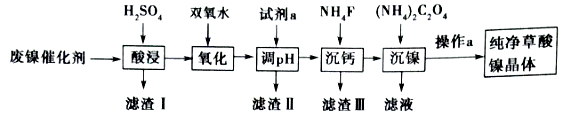
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_________________________________ 。
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:______________________ 。
(3)试剂a“调pH”时pH的调控范围为___________ ,试剂a为___________ (填字母)
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:_________________________________ 。当Ca2+沉淀完全时,溶液中c(F-)>___________ mol·L-1(写出计算式即可)。证明Ni2+已经沉淀完全的实验操作及现象是_________________________________ 。
(5)操作a的内容是_______________________________________________________ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:
(3)试剂a“调pH”时pH的调控范围为
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:
(5)操作a的内容是
您最近一年使用:0次
2019-02-05更新
|
708次组卷
|
3卷引用:【市级联考】广西壮族自治区柳州市2019届高三上学期1月模拟考试理科综合化学试题
名校
解题方法
3 . 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
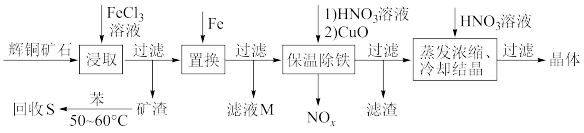
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________ (填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________ ;向“滤液M”中加入(或通入) ____________ (填母代号),可得到另一种流程中可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)“矿渣”中除了S以外,还有
(3)“保温除铁”过程中,加入CuO的目的是
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为
a.铁 b.氯气 c.高锰酸钾

您最近一年使用:0次
2018-04-07更新
|
391次组卷
|
4卷引用:【全国百强校】广西柳州高级中学2018届高三5月冲刺模拟理科综合化学试题
解题方法
4 . 铜及其化合物有广泛的应用。氯化亚铜(CuCl)微溶于水,不溶于酒精,在潮湿空气中易水解氧化。某课外小组以某工业废渣(主要成分为硅、铜、碳等)为原料制备CuCl的流程示意图如图所示。
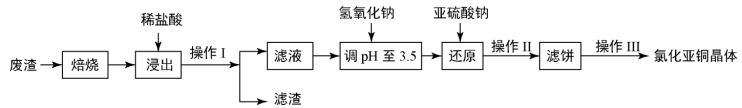
(1)“滤渣”的主要成分为______ (填化学式)。
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:_________ 。
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是______ (用化学方程式表示)。
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是__________ 。
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是__________ ,操作Ⅲ中包括对滤饼的醇洗,醇洗的目的是_________ 。
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl- [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度__________ (填写“变大”、“变小”或“”不变)。

(1)“滤渣”的主要成分为
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl-
 [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度
您最近一年使用:0次
解题方法
5 . 硝酸铜是常用的一种无机化学试剂
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是__________
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在_________ 范围
③在滤液蒸发浓缩步骤中,适当加入稀硝酸的作用是__________________________
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2•6H O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:

①当温度27℃<T<120℃时,反应的化学方程式为________ ②剩余固体质量为38.4g时,固体成分为【Cu(NO3)2•2Cu(OH)2】,当温度120℃<T<800℃时,反应的化学方程式为________ (此温度下,HNO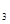 也分解)③当剩余固体质量为21.6g时,固体的化学式为
也分解)③当剩余固体质量为21.6g时,固体的化学式为_____________________
(3)制备无水硝酸铜的方法之一是用Cu与液态N O
O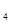 反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是
反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是_________________
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO调节溶液的pH,根据下表数据,溶液的pH应保持在
| 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)某研究学习小组将一定质量的硝酸铜晶体【Cu(NO3)2•6H
 O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
O】放在坩埚中加热,在不同温度阶段进行质量分析,绘制出剩余固体质量分数与温度关系如下图所示。据图回答下列问题:
①当温度27℃<T<120℃时,反应的化学方程式为
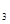 也分解)③当剩余固体质量为21.6g时,固体的化学式为
也分解)③当剩余固体质量为21.6g时,固体的化学式为(3)制备无水硝酸铜的方法之一是用Cu与液态N
 O
O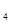 反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是
反应,反应过程中有无色气体放出,遇到空气变红棕色。反应的化学方程式是
您最近一年使用:0次



