名校
解题方法
1 . 某研究小组以工厂废渣(含Fe3O4、Al2O3、SiO2)为原料制取Fe2O3工艺流程如图。回答下列问题:

已知:SiO2不溶于水,不与H2SO4反应,能与NaOH溶液反应。
(1)“酸溶”时发生反应的化学方程式为____ 。
(2)“操作a”的名称为____ ,用到的玻璃仪器有玻璃棒、____ 。
(3)①“氧化”的目的是___ 。检验氧化不完全可加入的试剂是___ 。___ 用H2O2代替O2(填“能”或“不能”)。
②若O2完全“氧化”溶液中的溶质,取出部分被完全氧化后的溶液,将Cu片放入,反应一段时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则溶液中Cu2+和Fe3+的物质的量之比为___ (不考虑溶液体积变化)
(4)“沉铁”步骤可观察到现象是____ 。___ 用氨水代替NaOH溶液(填“能”或“不能”)。
(5)操作c中所发生的化学反应方程式为____ 。

已知:SiO2不溶于水,不与H2SO4反应,能与NaOH溶液反应。
(1)“酸溶”时发生反应的化学方程式为
(2)“操作a”的名称为
(3)①“氧化”的目的是
②若O2完全“氧化”溶液中的溶质,取出部分被完全氧化后的溶液,将Cu片放入,反应一段时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则溶液中Cu2+和Fe3+的物质的量之比为
(4)“沉铁”步骤可观察到现象是
(5)操作c中所发生的化学反应方程式为
您最近一年使用:0次
2 . 钼酸钠晶体(Na2MoO4·2H2O)常用于配制金属缓蚀剂。下图是利用钼精矿(主要成分是MoS2含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是________ ;
(2)“焙烧”反应为2MoS2+7O2 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是_______ (填化学式),写出一条提高焙烧效率的措施_______________ 。
(3)“浸取”时含钼化合物发生反应的离子方程式为______________ 。
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是___ mol/L[已知:Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8;
(5)将粗品进一步提纯的操作名称是__________ 。
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为_________ 。
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。
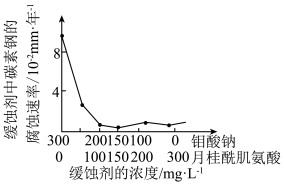
要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为___ mol/L。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是
(2)“焙烧”反应为2MoS2+7O2
 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是(3)“浸取”时含钼化合物发生反应的离子方程式为
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO
 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是(5)将粗品进一步提纯的操作名称是
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。

要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为
您最近一年使用:0次
3 . 用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下:

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的PH

(1)H2SO4溶解Al2O3的离子方程式是____________ 。
(2)检验滤液中还存在Fe2+的方法是______________ 。
(3)“除杂”环节有如下几个步骤:(I)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2 (II)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤I 的目的是:_________ ;调节溶液的pH为3.2的目的是__________ 。
②向步骤II的沉淀中加入浓HCl并加热,有黄绿色气体生成,写出其反应方程式______ 。
③步骤Ⅲ中加入MnSO4的目的是__________ (用离子反应方程式表示)
(4)从多次循环使用后母液中可回收的主要物质是________ (填化学式)。

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的PH

(1)H2SO4溶解Al2O3的离子方程式是
(2)检验滤液中还存在Fe2+的方法是
(3)“除杂”环节有如下几个步骤:(I)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2 (II)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤I 的目的是:
②向步骤II的沉淀中加入浓HCl并加热,有黄绿色气体生成,写出其反应方程式
③步骤Ⅲ中加入MnSO4的目的是
(4)从多次循环使用后母液中可回收的主要物质是
您最近一年使用:0次
2020-10-18更新
|
735次组卷
|
2卷引用:2017届广西柳州市高三10月模拟理综化学试卷
名校
4 . 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是______ ,操作②的名称是_________ 。
(2)试剂a是________ (填化学式,下同),试剂b是_______ ,固体B是________ 。
(3)加入试剂a所发生反应的化学方程式为_______ 。加入试剂b所发生反应的离子方程式为______ 。
(4)该方案能否达到实验目的:_____ (填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)___ 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____ 的质量。

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是
(2)试剂a是
(3)加入试剂a所发生反应的化学方程式为
(4)该方案能否达到实验目的:
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是
您最近一年使用:0次
2020-06-10更新
|
668次组卷
|
24卷引用:2015-2016学年广西柳州铁路第一中学高一上段考化学试卷
2015-2016学年广西柳州铁路第一中学高一上段考化学试卷湖南省长沙市第一中学2017-2018学年高一上学期期中考试化学试题2018-2019学年高一人教版化学必修1:第一章从实验学化学练习题湖北省武汉市钢城四中2018-2019学年高一上学期10月月考化学试题(已下线)【走进新高考】(人教版必修一)第一章 从实验学化学 单元练习02云南省楚雄州南华县第一中学2018-2019学年高一上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省昭通市盐津县水田新区中学2018-2019学年高一上学期11月份考试化学试题贵州省黄平县且兰高级中学2018-2019学年高一上学期12月份考试化学试题安徽省阜阳市第三中学2019-2020学年高一上学期第一次调研考试化学试题云南省昭通市巧家县二中2019-2020学年高一10月月考化学试题贵州省贵阳一中2019—2020学年度高一上学期第一次月考化学试题云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高一10月月考化学试题云南省施甸县第一中学2019-2020学年高一12月月考化学试题人教版高中化学必修1第一章《从实验学化学》测试卷5人教版高中化学必修1第一章《从实验学化学》测试卷6云南省永善县第二中学2019—2020学年高一上学期期末考试化学试题广西贺州市富川县民族中学2019-2020学年高一上学期期末考试化学试题四川省攀枝花市第十五中学2019-2020学年高一上学期期中考试化学试题(已下线)第一章 从实验学化学(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)河南省南阳市第一中学2020-2021学年高一上学期第一次月考化学试题四川省冕宁中学2020-2021学年高一上学期期中考试化学试题河北省承德第一中学2020-2021学年高一下学期第二次月考化学试题
5 . 某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________ 和_______ 。
(2)滤渣1中主要含______ 。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______ 。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______ ,NH4VO3煅烧过程中的化学方程式是______ 。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________ 。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____ ,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______ (保留两位有效数字)。
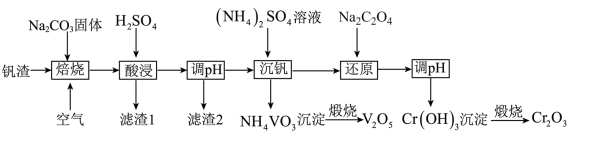
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为
(2)滤渣1中主要含
(3)“沉钒”时的离子方程式是
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019·广西柳州·一模
6 . Ag2O—Zn纽扣电池的固体拆解物中含Ag2O、Ag、Zn、Cu、石墨等物质,从中可提取金属银。如图是简要生产流程。
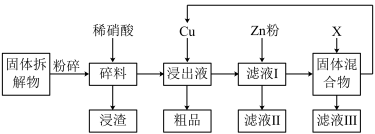
(1)固体拆解物需先粉碎的目的是___ 。
(2)浸渣的主要成分是___ 。
(3)以上流程中可循环使用的物质是___ ,除此之外,你认为通过对___ (填流程图中的物质代号)的回收处理,还有可能实现___ (填化学式)的循环利用。
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是___ (用离子方程式表示).
(5)有人在实验室中利用如下方案回收银:
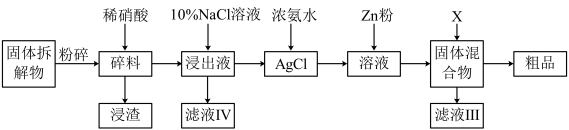
已知:Ag++2NH3 [Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
写出AgCl(s)与NH3反应的离子方程式___ ,该反应的平衡常数K=___ 。
(6)上述两种回收方案中都用到了试剂X,X是___ 。
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag___ g(列出计算式,已知1个电子所带电量为1.6×10-19C,阿伏加 德罗常数的值用NA表示)。

(1)固体拆解物需先粉碎的目的是
(2)浸渣的主要成分是
(3)以上流程中可循环使用的物质是
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是
(5)有人在实验室中利用如下方案回收银:

已知:Ag++2NH3
 [Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10写出AgCl(s)与NH3反应的离子方程式
(6)上述两种回收方案中都用到了试剂X,X是
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag
您最近一年使用:0次
名校
解题方法
7 . 某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
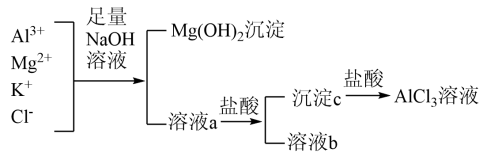
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_________________ 。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________ 。
(3)在溶液a中加入盐酸时需控制盐酸的量,为什么?___________ 。为此,改进方法是___________ 。

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
(2)氢氧化钠溶液能否用氨水代替,为什么?
(3)在溶液a中加入盐酸时需控制盐酸的量,为什么?
您最近一年使用:0次
2019-12-05更新
|
115次组卷
|
3卷引用:广西柳州市第二中学2019-2020学年高一上学期11月月考化学试题
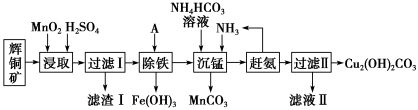
8 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________ (任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________ 。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________ ,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________ mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________ 。
(5)“赶氨”时,最适宜的操作方法是________________ 。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________ 。

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
2019-12-04更新
|
679次组卷
|
4卷引用:广西柳州市高级中学2020届高三上学期第二次统测理综化学试题
名校
解题方法
9 . 通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是
| A.HCl | B.Cl2 | C.NH3 | D.N2 |
您最近一年使用:0次
名校
10 . 工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)制取铜的操作流程如下:

已知:Cu2O+2H+===Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为_________ ;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________ (填仪器名称)。
(2)滤液A中铁元素的存在形式为________ (填离子符号),生成该离子的离子方程式为__________ ,检验滤液A中存在该离子的试剂为_____________ (填试剂名称)。
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为___________
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=________ 。
(5)利用电解法进行粗铜精炼时,下列叙述正确的是__________ (填代号)。
a 电能全部转化为化学能
b 粗铜接电源正极,发生氧化反应
c 精铜作阴极,电解后电解液中Cu2+浓度减小
d 粗铜精炼时通过的电量与阴极析出铜的量无确定关系

已知:Cu2O+2H+===Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为
(2)滤液A中铁元素的存在形式为
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=
(5)利用电解法进行粗铜精炼时,下列叙述正确的是
a 电能全部转化为化学能
b 粗铜接电源正极,发生氧化反应
c 精铜作阴极,电解后电解液中Cu2+浓度减小
d 粗铜精炼时通过的电量与阴极析出铜的量无确定关系
您最近一年使用:0次
2019-06-28更新
|
193次组卷
|
2卷引用:广西柳江中学2018-2019学年高二下学期期中考试理科综合化学试题



