1 . 钨是国防及高新技术应用中极为重要的功能材料之一,由黑钨矿[主要成分是钨酸亚铁( )、钨酸锰(
)、钨酸锰(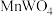 ),以及少量的Si、As元素]冶炼钨的流程如下:
),以及少量的Si、As元素]冶炼钨的流程如下:
①钨酸(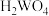 )酸性很弱,难溶于水。
)酸性很弱,难溶于水。
②水浸液中含有 、
、 、
、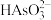 、
、 等阴离子。
等阴离子。
回答下列问题:
(1)“焙烧”前,需将黑钨矿粉碎,目的是_______ 。
(2)“焙烧”过程中,生成 的化学方程式为
的化学方程式为_______ 。
(3)“净化”过程中, 的作用是
的作用是_______ 。
(4)“酸化”过程中,发生反应的离子方程式为_______ 。
(5)“高温还原”过程中,被还原的物质与被氧化的物质的物质的量之比为_______ 。
(6)硬质合金刀具中含碳化钨(WC,碳元素为-4价),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸沉淀并放出 气体,则阳极的电极反应式为
气体,则阳极的电极反应式为_______ 。
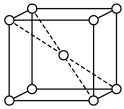
(7)钨晶胞为体心立方晶胞,晶胞结构如图所示(注:晶胞体对角线的W原子相切),则钨晶胞的原子空间利用率为_______(填标号。晶胞的原子空间利用率=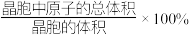 )。
)。
 )、钨酸锰(
)、钨酸锰(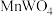 ),以及少量的Si、As元素]冶炼钨的流程如下:
),以及少量的Si、As元素]冶炼钨的流程如下:
①钨酸(
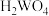 )酸性很弱,难溶于水。
)酸性很弱,难溶于水。②水浸液中含有
 、
、 、
、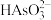 、
、 等阴离子。
等阴离子。回答下列问题:
(1)“焙烧”前,需将黑钨矿粉碎,目的是
(2)“焙烧”过程中,生成
 的化学方程式为
的化学方程式为(3)“净化”过程中,
 的作用是
的作用是(4)“酸化”过程中,发生反应的离子方程式为
(5)“高温还原”过程中,被还原的物质与被氧化的物质的物质的量之比为
(6)硬质合金刀具中含碳化钨(WC,碳元素为-4价),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸沉淀并放出
 气体,则阳极的电极反应式为
气体,则阳极的电极反应式为(7)钨晶胞为体心立方晶胞,晶胞结构如图所示(注:晶胞体对角线的W原子相切),则钨晶胞的原子空间利用率为_______(填标号。晶胞的原子空间利用率=
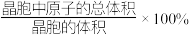 )。
)。
A. | B.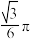 | C. | D. |
您最近一年使用:0次
解题方法
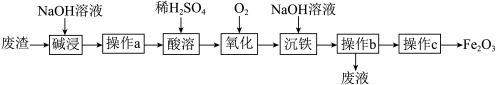
2 . 某研究小组以工厂废渣( 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
(1)“碱浸”时将固体磨碎的目的是_______ ,发生反应的离子方程式为_______ 。
(2)“操作a”需要的玻璃仪器有_______ 、_______ 、_______ 。
(3)“氧化”过程的离子方程式是_______ 。
(4)操作c的名称是_______ ;从分类的角度, 属于
属于_______ 。
(5)向 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是_______ ,反应后溶液中没有 的原因是
的原因是_______ (用离子方程式表示)。
 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
(1)“碱浸”时将固体磨碎的目的是
(2)“操作a”需要的玻璃仪器有
(3)“氧化”过程的离子方程式是
(4)操作c的名称是
 属于
属于(5)向
 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是 的原因是
的原因是
您最近一年使用:0次
3 . 铝和铁是地壳中含量较多的金属元素,其单质和化合物广泛应用于日常生活中。回答下列问题:
(1)工业制印刷电路板的原理为用 做腐蚀液,将覆铜板上不需要的铜腐蚀。写出相关反应的离子方程式:
做腐蚀液,将覆铜板上不需要的铜腐蚀。写出相关反应的离子方程式:_______ 。
(2)向 溶液中加入
溶液中加入 溶液时,生成的
溶液时,生成的_______ 色絮状沉淀最终变为_______ 色的_______ (填化学式)。
(3)甲、乙两烧杯中分别盛有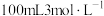 盐酸和
盐酸和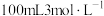 氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1:2(同温同压下),则加入铝粉的质量为
氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1:2(同温同压下),则加入铝粉的质量为_______ g。
(4)如图是从铝土矿(主要成分为 ,还含有少量
,还含有少量 等杂质)中提取
等杂质)中提取 并生产
并生产 的工艺流程:
的工艺流程:
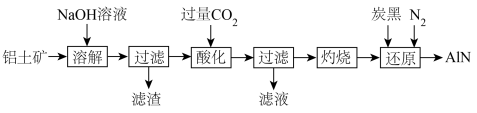
①“滤渣”的主要成分为_______ (填化学式,下同),滤液中溶液的主要成分为_______ 。
②向“滤渣”中加入稀硫酸后,检验反应后溶液中存在 的试剂为
的试剂为_______ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
③过滤操作中需要用到的玻璃仪器有_______ 。
④“还原”时,炭黑在高温下被氧化为 ,该还原过程中发生的化学反应方程式为
,该还原过程中发生的化学反应方程式为_______ 。
(1)工业制印刷电路板的原理为用
 做腐蚀液,将覆铜板上不需要的铜腐蚀。写出相关反应的离子方程式:
做腐蚀液,将覆铜板上不需要的铜腐蚀。写出相关反应的离子方程式:(2)向
 溶液中加入
溶液中加入 溶液时,生成的
溶液时,生成的(3)甲、乙两烧杯中分别盛有
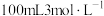 盐酸和
盐酸和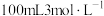 氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1:2(同温同压下),则加入铝粉的质量为
氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1:2(同温同压下),则加入铝粉的质量为(4)如图是从铝土矿(主要成分为
 ,还含有少量
,还含有少量 等杂质)中提取
等杂质)中提取 并生产
并生产 的工艺流程:
的工艺流程:
①“滤渣”的主要成分为
②向“滤渣”中加入稀硫酸后,检验反应后溶液中存在
 的试剂为
的试剂为A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液③过滤操作中需要用到的玻璃仪器有
④“还原”时,炭黑在高温下被氧化为
 ,该还原过程中发生的化学反应方程式为
,该还原过程中发生的化学反应方程式为
您最近一年使用:0次
解题方法
4 . 牙膏是我们日常生活中的常用物品。牙膏中常用摩擦剂有① 、②
、② 、③
、③ 、④
、④ 。某实验室设计两种工艺流程制取超细
。某实验室设计两种工艺流程制取超细 ,其原理如图所示。回答下列问题:
,其原理如图所示。回答下列问题:

(1)推测 、
、 的溶解性:
的溶解性:___________ (填写“易溶于水”、“难溶于水”)。
(2)若 属于碱,
属于碱, 与盐酸反应的离子方程式是
与盐酸反应的离子方程式是___________ 。
(3)操作a用的玻璃仪器是___________ 。操作b是过滤、洗涤。洗涤方法是___________ 。
(4)方案一“沉钙”时发生反应的离子方程式为___________ 。
(5)方案二“酸浸”时发生反应的离子方程式是___________ 。若生成44g气体B,则消耗___________  。
。
 、②
、② 、③
、③ 、④
、④ 。某实验室设计两种工艺流程制取超细
。某实验室设计两种工艺流程制取超细 ,其原理如图所示。回答下列问题:
,其原理如图所示。回答下列问题:
(1)推测
 、
、 的溶解性:
的溶解性:(2)若
 属于碱,
属于碱, 与盐酸反应的离子方程式是
与盐酸反应的离子方程式是(3)操作a用的玻璃仪器是
(4)方案一“沉钙”时发生反应的离子方程式为
(5)方案二“酸浸”时发生反应的离子方程式是
 。
。
您最近一年使用:0次
名校
解题方法
5 . 实验室用 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是
 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是A.制备氯气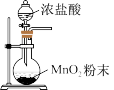 | B.收集氯气 |
C.过滤除MnO2 | D.浓缩滤液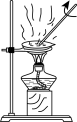 |
您最近一年使用:0次
2023-08-21更新
|
143次组卷
|
5卷引用:广西河池市八校2021-2022学年高二下学期第二次联考化学试题
6 . 工业上常以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2等)为原料,生产Fe3O4(Fe3O4中1个Fe呈+2价,2个Fe呈+3价)和铝单质的工艺流程如图所示:

已知:①FeS2在“焙烧Ⅰ”过程中,发生反应的化学方程式为 ;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为
;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为 。
。
(1)FeS2中硫的化合价为______ 价;碱浸后滤渣的主要成分有______ (填化学式)。
(2)矿粉经过“焙烧Ⅰ”后,所得的大块烧渣需要进行“碱浸”,为了加快浸取的速率,可采取的措施有_________________ 、_________________ (任写两点)。
(3)写出流程中过量CO2通入滤液中发生反应的离子方程式:____________________ 。
(4)反应中产生的污染性气体SO2,可用下列哪种溶液吸收______(填字母)。
(5)工业上,常用熔融的氧化铝为原料冶炼金属Al,发生反应的化学方程式为 。生成的气体可以在流程的
。生成的气体可以在流程的______ (填“焙烧Ⅰ”“焙烧Ⅱ”或“焙烧Ⅲ”)中循环使用。

已知:①FeS2在“焙烧Ⅰ”过程中,发生反应的化学方程式为
 ;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为
;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为 。
。(1)FeS2中硫的化合价为
(2)矿粉经过“焙烧Ⅰ”后,所得的大块烧渣需要进行“碱浸”,为了加快浸取的速率,可采取的措施有
(3)写出流程中过量CO2通入滤液中发生反应的离子方程式:
(4)反应中产生的污染性气体SO2,可用下列哪种溶液吸收______(填字母)。
| A.浓硫酸 | B.硝酸 | C.NaOH溶液 | D.氨水 |
 。生成的气体可以在流程的
。生成的气体可以在流程的
您最近一年使用:0次
名校
解题方法
7 . 侯德榜是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可,其工艺流程如图。下列说法正确的是


| A.该工艺流程中涉及了氧化还原反应 |
B.向“饱和食盐水”中先通入过量 ,再通入 ,再通入 |
| C.“母液”中溶质的主要成分是NaCl,可循环利用 |
| D.由流程图可知,碳酸氢钠固体中混有少量碳酸钠,可通过煅烧,除去碳酸钠 |
您最近一年使用:0次
2023-04-22更新
|
1303次组卷
|
8卷引用:广西壮族自治区河池市2022-2023学年高一上学期期末考试化学试题
广西壮族自治区河池市2022-2023学年高一上学期期末考试化学试题(已下线)专题八工艺流程图(练)(已下线)第4讲 钠及其重要化合物(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)湖北省黄石市第二中学2023-2024学年高二上学期9月月考化学试题甘肃省武威市凉州区2024届高三第三次诊断考试化学试题云南省昆明市第八中学2023-2024学年高一上学期11月期中考试化学试题河北省唐山市遵化市第一中学2023-2024学年高三上学期月考2 化学试题
解题方法
8 . 下列除去杂质(括号中的物质为杂质)的方法中,正确的是
| 选项 | 被提纯的物质 | 除杂方法 |
| A | NaBr溶液(NaCl) | 通入适量的 |
| B | 液溴(水) | 加入适量 ,萃取、分液、蒸馏 ,萃取、分液、蒸馏 |
| C |  气体(HCl) 气体(HCl) | 依次通过NaOH溶液和浓硫酸 |
| D | NaOH溶液( ) ) | 加入适量的氯化钡溶液,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图所示。

金属离子成的pH:
(1)写出酸浸池中MnCO3溶解的离子方程式:____ 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加氨水时发生反应的离子方程式:____ 。
(3)沉淀池2中,____ (填“能”或“不能”)用NaOH代替含硫沉淀剂,原因是____ 。
(4)用酸性高锰酸钾溶液可以检验Mn2+,产生黑色沉淀,该反应的离子方程式为____ 。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下:
i.称取ωg废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于250mL容量瓶中;
ii.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用xmol·L-1(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为ymL,MnO 重新转化成Mn2+。
重新转化成Mn2+。
①步骤iii中反应的离子方程式为____ 。
②废渣中锰元素的质量分数为___ 。
(6)电解MnSO4溶液可获得二氧化锰,电解后的废水中还含有Mn2+,可用碱性溶液进行沉降得到Mn(OH)2沉淀。欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1,则应使溶液中c(OH-)≥____ mol·L-1。

金属离子成的pH:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀时的pH | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀时的pH | 2.8 | 8.3 | 94 | 10.2 |
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加氨水时发生反应的离子方程式:
(3)沉淀池2中,
(4)用酸性高锰酸钾溶液可以检验Mn2+,产生黑色沉淀,该反应的离子方程式为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下:
i.称取ωg废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于250mL容量瓶中;
ii.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用xmol·L-1(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为ymL,MnO
 重新转化成Mn2+。
重新转化成Mn2+。①步骤iii中反应的离子方程式为
②废渣中锰元素的质量分数为
(6)电解MnSO4溶液可获得二氧化锰,电解后的废水中还含有Mn2+,可用碱性溶液进行沉降得到Mn(OH)2沉淀。欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1,则应使溶液中c(OH-)≥
您最近一年使用:0次
10 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及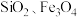 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
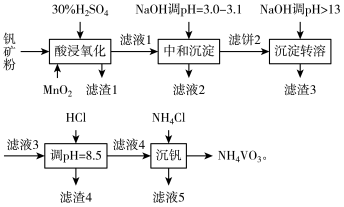
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是___________ 。
(2)“酸浸氧化”中,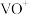 和
和 均被氧化成
均被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出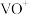 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和___________ ,以及部分的___________ 。
(4)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是___________ 。
(5)用HCl“调 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为___________ 。
(6)“沉钒”反应的离子方程式为___________ 。
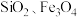 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH值 | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀的pH值 | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是
(2)“酸浸氧化”中,
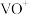 和
和 均被氧化成
均被氧化成 ,同时还有
,同时还有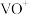 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和(4)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是(5)用HCl“调
 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为(6)“沉钒”反应的离子方程式为
您最近一年使用:0次



