解题方法
1 . 某研究小组以工厂废渣( 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
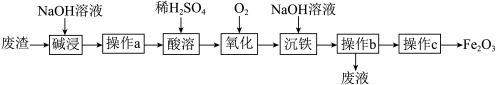
(1)“碱浸”时将固体磨碎的目的是_______ ,发生反应的离子方程式为_______ 。
(2)“操作a”需要的玻璃仪器有_______ 、_______ 、_______ 。
(3)“氧化”过程的离子方程式是_______ 。
(4)操作c的名称是_______ ;从分类的角度, 属于
属于_______ 。
(5)向 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是_______ ,反应后溶液中没有 的原因是
的原因是_______ (用离子方程式表示)。
 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
(1)“碱浸”时将固体磨碎的目的是
(2)“操作a”需要的玻璃仪器有
(3)“氧化”过程的离子方程式是
(4)操作c的名称是
 属于
属于(5)向
 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是 的原因是
的原因是
您最近一年使用:0次
解题方法
2 . 牙膏是我们日常生活中的常用物品。牙膏中常用摩擦剂有① 、②
、② 、③
、③ 、④
、④ 。某实验室设计两种工艺流程制取超细
。某实验室设计两种工艺流程制取超细 ,其原理如图所示。回答下列问题:
,其原理如图所示。回答下列问题:

(1)推测 、
、 的溶解性:
的溶解性:___________ (填写“易溶于水”、“难溶于水”)。
(2)若 属于碱,
属于碱, 与盐酸反应的离子方程式是
与盐酸反应的离子方程式是___________ 。
(3)操作a用的玻璃仪器是___________ 。操作b是过滤、洗涤。洗涤方法是___________ 。
(4)方案一“沉钙”时发生反应的离子方程式为___________ 。
(5)方案二“酸浸”时发生反应的离子方程式是___________ 。若生成44g气体B,则消耗___________  。
。
 、②
、② 、③
、③ 、④
、④ 。某实验室设计两种工艺流程制取超细
。某实验室设计两种工艺流程制取超细 ,其原理如图所示。回答下列问题:
,其原理如图所示。回答下列问题:
(1)推测
 、
、 的溶解性:
的溶解性:(2)若
 属于碱,
属于碱, 与盐酸反应的离子方程式是
与盐酸反应的离子方程式是(3)操作a用的玻璃仪器是
(4)方案一“沉钙”时发生反应的离子方程式为
(5)方案二“酸浸”时发生反应的离子方程式是
 。
。
您最近一年使用:0次
名校
解题方法
3 . 实验室用 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是
 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是A.制备氯气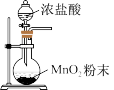 | B.收集氯气 |
C.过滤除MnO2 | D.浓缩滤液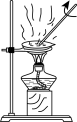 |
您最近一年使用:0次
2023-08-21更新
|
148次组卷
|
5卷引用:广西河池市八校2021-2022学年高二下学期第二次联考化学试题
4 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及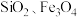 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
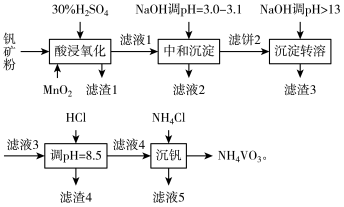
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是___________ 。
(2)“酸浸氧化”中,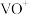 和
和 均被氧化成
均被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出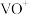 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和___________ ,以及部分的___________ 。
(4)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是___________ 。
(5)用HCl“调 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为___________ 。
(6)“沉钒”反应的离子方程式为___________ 。
 。采用以下工艺流程可由黏土矿制备
。采用以下工艺流程可由黏土矿制备 。
。
该工艺条件下,溶液中金属离子开始和完全沉淀的pH值如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH值 | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀的pH值 | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”时需要加热,其目的是
(2)“酸浸氧化”中,
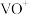 和
和 均被氧化成
均被氧化成 ,同时还有
,同时还有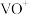 被氧化成
被氧化成 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 。随滤液2可除去金属离子
。随滤液2可除去金属离子 和
和(4)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣3的主要成分是
转化为钒酸盐溶解。滤渣3的主要成分是(5)用HCl“调
 ”时有沉淀生成,生成该滤渣4反应的化学方程式为
”时有沉淀生成,生成该滤渣4反应的化学方程式为(6)“沉钒”反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
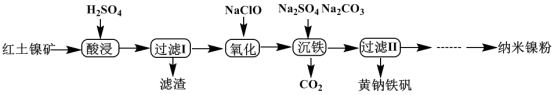
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是

已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并 |
| C.“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2021-03-18更新
|
1179次组卷
|
6卷引用:广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题
广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题湖北省八市2021届高三下学期(3月)联考化学试题(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)考向06 钠及其重要化合物-备战2022年高考化学一轮复习考点微专题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
解题方法
6 . 某电子厂排放的酸性废液中含有Fe3+、Cu2+、Fe2+、Cl-等离子,以这种废液为原料设计制备高纯Fe2O3的工艺流程如图(部分操作和条件略):

已知:①HCl(浓)+FeCl3 HFeCl4(易溶于有机溶剂);
HFeCl4(易溶于有机溶剂);
②Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3。
回答下列问题:
(1)工厂废液浓缩的目的是_______ ,通入氯气发生的氧化还原反应离子方程式为_______ 。
(2)萃取剂要求:①被萃取物在其中的溶解度要大、②与原溶剂不互溶、③_______ ,加水反萃取能发生的原因是_______ (从化学平衡的角度进行解释)。
(3)加入氨水得到的沉淀常用冰水洗涤,目的是_______ ,检验洗涤是否干净的操作为:取最后一次洗出液,向其中滴加_______ ,观察是否有沉淀生成。
(4)加入氨水使溶液中的Fe3+沉淀完全(浓度小于1×10-5 mol·L-1),需调节溶液pH范围为_______ 。

已知:①HCl(浓)+FeCl3
 HFeCl4(易溶于有机溶剂);
HFeCl4(易溶于有机溶剂);②Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3。
回答下列问题:
(1)工厂废液浓缩的目的是
(2)萃取剂要求:①被萃取物在其中的溶解度要大、②与原溶剂不互溶、③
(3)加入氨水得到的沉淀常用冰水洗涤,目的是
(4)加入氨水使溶液中的Fe3+沉淀完全(浓度小于1×10-5 mol·L-1),需调节溶液pH范围为
您最近一年使用:0次
2021-03-18更新
|
213次组卷
|
2卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
名校
解题方法
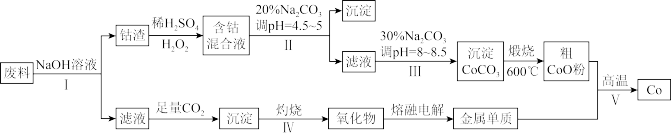
7 . 钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3和Fe2O3等物质)。
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________ 。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________ 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________ 。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________ 。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________ (填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________ 。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
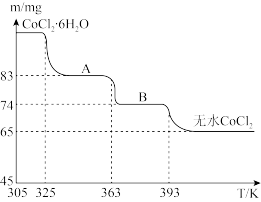
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________ 。

请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是

您最近一年使用:0次
2019-12-05更新
|
342次组卷
|
4卷引用:广西河池高级中学2022届高三下学期4月考试理科综合化学试题
广西河池高级中学2022届高三下学期4月考试理科综合化学试题湖北省示范高中2019~2020学年高三11月月考理综化学试题(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编陕西省西安市长安区第一中学2022-2023学年高三上学期第二次质量检测化学试题
名校
8 . 从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:
已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
| A.合理处理废铅蓄电池有利于资源再利用和防止重金属污染 |
| B.步骤①中可用浓硫酸代替浓盐酸 |
| C.步骤①、②、③中均涉及过滤操作 |
D.PbSO4(s)+2Cl-(aq) PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4 PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4 |
您最近一年使用:0次
2019-03-22更新
|
1576次组卷
|
11卷引用:广西河池八校同盟体2022-2023学年高二下学期5月月考化学试题
广西河池八校同盟体2022-2023学年高二下学期5月月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2020届高三上学期第一次调研考试(9月)化学试题吉林省吉林市第一中学2020届高三上学期第二次调研考试(11月)化学试题甘肃省张掖市第二中学2020届高三上学期10月月考化学试题【校级联考】河南省九师联盟2019届高三上学期1月质量检测理科综合化学试题辽宁省抚顺市抚顺高中2019届高三模拟考试 化学福建省厦门双十中学2020届高三上学期期中考试化学试题模拟卷01(必考)——2020年秋高三化学开学摸底考试卷(全国通用)河南省原阳县第三高级中学2020-2021学年高二下学期期末考试化学试题广东省潮州市2020-2021学年高三上学期期末考试化学试题陕西省榆林市府谷中学四校联考2022-2023学年高二下学期第一次联考化学试题
解题方法
9 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如右(加热和夹持装置等略):
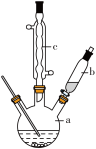
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是____________________ 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是____________________ ;仪器b的名称是____________________ ,其作用是____________________ 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________________ 。下列仪器中可用于分离苯乙酸粗品的是(填标号)。____________________
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是____________________ ,最终得到44g纯品,则苯乙酸的产率是____________________ 。
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是____________________ 。
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为____________________ (填仪器名称)即可解决此问题。

制备苯乙酸的装置示意图如右(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器c的作用是
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
(6)在实际操作时,发现b中液体不容易滴下来,你认为应将b改为
您最近一年使用:0次
名校
10 . 某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程:

请回答以下问题:
(1)工业合成氨反应的条件是_____________________ 。沉淀池中发生的主要反应方程式是________________________ 。该反应能够发生的原因是__________________________ 。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________ (填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:__________ (填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是_______________ ,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________ .缺点是_____________ 。

请回答以下问题:
(1)工业合成氨反应的条件是
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是
您最近一年使用:0次



