解题方法
1 . 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色等。工业上常用辉铋矿(主要成分是 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。 在
在 时开始水解,
时开始水解,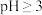 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为___________ 。
(2)“浸渣”的主要成分是S和___________ ,“浸取”时生成S的离子方程式为___________ 。
(3)“充分搅拌”时加入盐酸羟胺的目的是___________ 。
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为___________ ,发生反应的化学方程式为___________ 。
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是___________ 。
(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。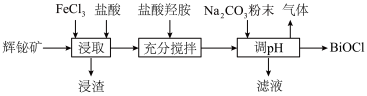
 在
在 时开始水解,
时开始水解,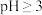 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
| 金属离子 |  |  |
| 开始沉淀的pH | 1.9 | 7.2 |
| 沉淀完全的pH | 2.9 | 8.2 |
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为
(2)“浸渣”的主要成分是S和
(3)“充分搅拌”时加入盐酸羟胺的目的是
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入
 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。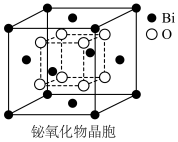
您最近一年使用:0次
2024-04-01更新
|
612次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
2 . 对某溶液中部分离子的定性检测流程如下。相关分析正确的是

| A.步骤①所加试剂可以是浓KOH溶液 |
| B.可以用湿润的蓝色石蕊试纸检验生成的无色气体 |
C.步骤②发生的反应为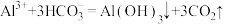 |
D. 遇铁氰化钾会生成蓝色溶液 遇铁氰化钾会生成蓝色溶液 |
您最近一年使用:0次
2024-03-06更新
|
629次组卷
|
17卷引用:【全国百强校】广西柳州高级中学2018届高三5月冲刺模拟理科综合化学试题
【全国百强校】广西柳州高级中学2018届高三5月冲刺模拟理科综合化学试题四川省成都市2018届高三第二次诊断性检测理综化学试题山东省泰安第一中学2020届高三上学期期中模拟联合考试化学试题宁夏固原市五原中学补习部2021届高三上学期期中考试化学试题陕西省宝鸡市金台区2021届高三11月检测理综化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题(已下线)专题04 离子反应(缺项配平、离子检验、离子推断、共存)-2021年高考化学必做热点专题(已下线)小题07 描述型实验选择题(侧重物质检验、定量实验) ——备战2021年高考化学经典小题考前必刷(全国通用)2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学2024届陕西省西北工业大学附属中学高三第14次高考适应性训练理科综合试题-高中化学四川省成都外国语学校2017-2018学年高二6月(零诊模拟)月考化学试题黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题
名校
3 . 实验室模拟侯氏制碱法制备 的主要过程如下,下列说法正确的是
的主要过程如下,下列说法正确的是
 的主要过程如下,下列说法正确的是
的主要过程如下,下列说法正确的是
A.实验时应先向饱和食盐水中通入足量 再通入 再通入 |
| B.过程①②③均涉及过滤操作 |
C.向溶液A中加入 的作用是增大 的作用是增大 浓度,促进 浓度,促进 结晶析出 结晶析出 |
D.实验过程中可循环使用的物质只有 |
您最近一年使用:0次
名校
解题方法
4 . 为贯彻低碳循环的绿色发展理念,实现对废旧电池的高效资源化回收,湖南科技大学研究团队通过双氧水氧化→酸浸→浸出液二次浸出的工艺,回收废旧磷酸铁锂电池正极材料( )中的锂,同时得到有用的磷酸铁(
)中的锂,同时得到有用的磷酸铁( ),其工艺流程如下。回答下列问题:
),其工艺流程如下。回答下列问题:

(1)基态Fe原子的价层电子轨道表达式为___________ , 的电子式为
的电子式为___________ 。
(2)第一次浸出实验在一定条件下,浸出时间和浸出温度对Li、Fe、P的浸出率影响如下图所示。

①考虑实验效率和实际工业生产要求,选择的最佳浸出时间:___________ ,最佳浸出温度___________ 。
②随着浸出温度的上升,一定温度后Li的浸出率呈现下降的趋势,可能的原因为___________ 。
③滤渣A的主要成分为___________ ,则第一次浸出时主要反应的化学方程式为_________ 。
(3)除杂时加入NaOH的作用为调节溶液pH,使 沉淀完全,则调pH不得低于
沉淀完全,则调pH不得低于_________ 。
(已知: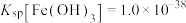 )
)
(4)提纯碳酸锂产品时得到的母液的主要成分是___________ (填化学式)。
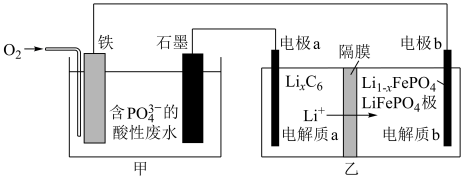
(5)某科研小组探究用磷酸铁锂电池处理含 的酸性废水,以得到有用的
的酸性废水,以得到有用的 ,其装置如图所示:请写出甲池中生成
,其装置如图所示:请写出甲池中生成 的反应方程式:
的反应方程式:___________ 。
 )中的锂,同时得到有用的磷酸铁(
)中的锂,同时得到有用的磷酸铁( ),其工艺流程如下。回答下列问题:
),其工艺流程如下。回答下列问题:
(1)基态Fe原子的价层电子轨道表达式为
 的电子式为
的电子式为(2)第一次浸出实验在一定条件下,浸出时间和浸出温度对Li、Fe、P的浸出率影响如下图所示。

①考虑实验效率和实际工业生产要求,选择的最佳浸出时间:
②随着浸出温度的上升,一定温度后Li的浸出率呈现下降的趋势,可能的原因为
③滤渣A的主要成分为
(3)除杂时加入NaOH的作用为调节溶液pH,使
 沉淀完全,则调pH不得低于
沉淀完全,则调pH不得低于(已知:
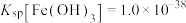 )
)(4)提纯碳酸锂产品时得到的母液的主要成分是
(5)某科研小组探究用磷酸铁锂电池处理含
 的酸性废水,以得到有用的
的酸性废水,以得到有用的 ,其装置如图所示:请写出甲池中生成
,其装置如图所示:请写出甲池中生成 的反应方程式:
的反应方程式:
您最近一年使用:0次
5 . 氯溴酸在医药和石化工业上有广泛用途,模拟工业制备氢溴酸的流程如图所示。下列说法不正确的是
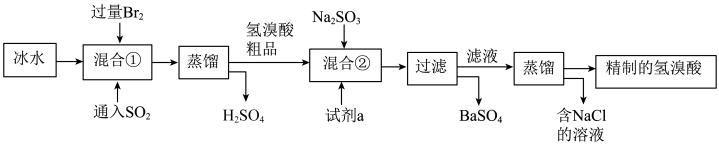

A.混合①使用冰水的目的是防止 和HBr挥发 和HBr挥发 |
B. 可除去氢溴酸粗品中的 可除去氢溴酸粗品中的 ,发生的离子反应为 ,发生的离子反应为 |
| C.蒸馏时,加完“滤液”后,先通冷凝水,再点燃酒精灯加热 |
D.工业氢溴酸常带有淡淡的黄色,可能是因为含有 |
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组设计如图实验装置制备次磷酸钠( )。
)。
已知:①白磷( )在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成
)在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成 和
和 。
。
② 是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成
是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成 。
。
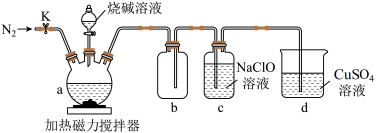
(1)仪器a的名称是___________ 。a中发生反应的化学方程式是___________ 。
(2)仪器b组成的装置的作用是___________ ,检查装置气密性后,应先打开K通入 一段时间,目的是
一段时间,目的是___________ 。
(3)下列有关说法正确的是___________。
(4)①仪器c中充分反应后生成 和NaCl,经过一系列操作可获得固体
和NaCl,经过一系列操作可获得固体 。相关物质的溶解度(S)如下:
。相关物质的溶解度(S)如下:
从下列选项a-g中选择合理的仪器或操作,补全如下步骤。
取仪器c中溶液,用蒸发皿___________ →用___________ (趁热过滤)→用烧杯(冷却结晶)→用漏斗(过滤得到 )→
)→___________ →干燥 粗品。
粗品。
选项:a.溶解 b.过滤 c.洗涤 d.普通三角漏斗 e.保温漏斗
f.蒸发浓缩至有大量晶体析出 g.蒸发浓缩至溶液表面出现晶膜
②写出c中发生反应的离子方程式___________ 。
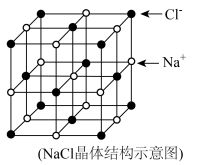
(5)NaCl晶胞结构如图,设距离最近的 间的距离为apm,
间的距离为apm, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。(列出计算式即可)
。(列出计算式即可)
 )。
)。已知:①白磷(
 )在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成
)在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成 和
和 。
。②
 是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成
是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成 。
。
(1)仪器a的名称是
(2)仪器b组成的装置的作用是
 一段时间,目的是
一段时间,目的是(3)下列有关说法正确的是___________。
A.次磷酸( )是三元酸 )是三元酸 |
| B.为加快反应速率,投料前应先在通风橱内将白磷碾成薄片状 |
C.反应结束后应继续通入 一段时间,可提高 一段时间,可提高 产率 产率 |
| D.d中所盛硫酸铜溶液可用酸性高锰酸钾溶液代替 |
(4)①仪器c中充分反应后生成
 和NaCl,经过一系列操作可获得固体
和NaCl,经过一系列操作可获得固体 。相关物质的溶解度(S)如下:
。相关物质的溶解度(S)如下: | S(25℃) | S(100℃) | |
| NaCl | 37 | 39 |
 | 100 | 667 |
取仪器c中溶液,用蒸发皿
 )→
)→ 粗品。
粗品。选项:a.溶解 b.过滤 c.洗涤 d.普通三角漏斗 e.保温漏斗
f.蒸发浓缩至有大量晶体析出 g.蒸发浓缩至溶液表面出现晶膜
②写出c中发生反应的离子方程式
(5)NaCl晶胞结构如图,设距离最近的
 间的距离为apm,
间的距离为apm, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。(列出计算式即可)
。(列出计算式即可)
您最近一年使用:0次
7 . 以闪锌矿( ,含有
,含有 和少量
和少量 、
、 、
、 杂质)为原料制备金属锌的流程如图所示:
杂质)为原料制备金属锌的流程如图所示:

相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
下列说法错误的是
 ,含有
,含有 和少量
和少量 、
、 、
、 杂质)为原料制备金属锌的流程如图所示:
杂质)为原料制备金属锌的流程如图所示:
相关金属离子[
 ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
A.“气体”主要是 | B.“调pH”的范围是2.8~7.4 |
C.通入 的目的是将 的目的是将 氧化为 氧化为 | D.“滤渣3”的主要成分是Cd |
您最近一年使用:0次
名校
解题方法
8 . 高纯氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(含磷酸盐、硅酸盐、铁、铅等)制备高纯氯化锰的工艺流程如图所示(部分操作和条件略)。
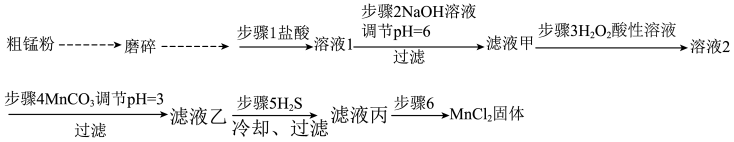
已知:生成氢氧化物沉淀的pH:
注:金属离子的起始浓度为0.1mol•L﹣1;当离子的浓度小于等于10﹣5mol•L﹣1时沉淀完全。
回答下列问题:
(1)将粗锰粉磨碎的目的是___________ 。
(2)步骤1和步骤2除去了磷酸盐和硅酸盐。非金属性P___________ Si(填写“大于”“小于”),从原子结构角度解释非金属性不同的原因是 ___________ 。
(3)所得滤液甲中的金属离子主要含有Mn2+、Fe2+和Pb2+等,且Pb2+不被H2O2氧化。加入H2O2目的是___________ 。(用离子方程式表示)。步骤4加入MnCO3得到沉淀的主要成分是 ___________ 。
(4)已知PbS的Ksp=8×10﹣28,MnS的Ksp=2×10﹣10.步骤5的目的是除去Pb2+,反应的离子方程式是___________ ,为了保证Pb2+除尽,控制溶液中S2﹣浓度范围是 ___________ 。(假设溶液中Mn2+、Pb2+的浓度是0.1mol•L﹣1)
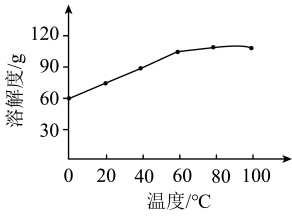
(5)已知;氯化锰的溶解度随温度的变化如图。步骤6的操作是___________ 、___________ 、过滤、洗涤、烘干。

已知:生成氢氧化物沉淀的pH:
| Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Pb(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 8.1 | 6.5 |
| 完全沉淀时 | 8.3 | 2.8 | 10.1 | 8.5 |
回答下列问题:
(1)将粗锰粉磨碎的目的是
(2)步骤1和步骤2除去了磷酸盐和硅酸盐。非金属性P
(3)所得滤液甲中的金属离子主要含有Mn2+、Fe2+和Pb2+等,且Pb2+不被H2O2氧化。加入H2O2目的是
(4)已知PbS的Ksp=8×10﹣28,MnS的Ksp=2×10﹣10.步骤5的目的是除去Pb2+,反应的离子方程式是
(5)已知;氯化锰的溶解度随温度的变化如图。步骤6的操作是

您最近一年使用:0次
名校
解题方法
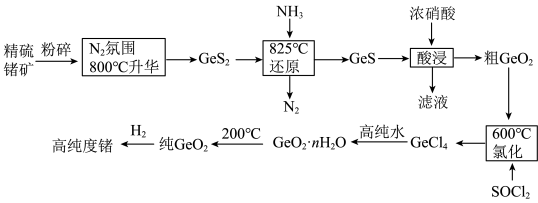
9 . 门捷列夫最早预言了具有半导体特性类硅元素锗(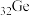 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②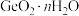 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。
(1)基态锗原子的价层电子排布式为___________ ,晶体锗的晶体类型是___________ 。
(2)800℃,使精硫锗矿在 氛围中升华的原因:
氛围中升华的原因:___________ 。
(3)还原时发生反应: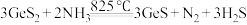 ,比较键角:
,比较键角:
___________  (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)___________ 。
(4)酸浸时温度不能过高的原因:___________ 。
(5)氯化除生成 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:___________ 。
(6) 水解得到
水解得到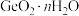 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是___________ 。
(7) 与碱反应可生成锗酸盐,其中
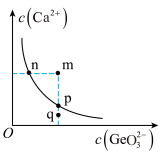
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
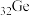 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②
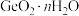 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。(1)基态锗原子的价层电子排布式为
(2)800℃,使精硫锗矿在
 氛围中升华的原因:
氛围中升华的原因:(3)还原时发生反应:
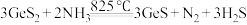 ,比较键角:
,比较键角:
 (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)(4)酸浸时温度不能过高的原因:
(5)氯化除生成
 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:(6)
 水解得到
水解得到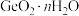 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是(7)
 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
A.n点与p点对应的 相等 相等 |
B.q点无 沉淀生成 沉淀生成 |
| C.通过蒸发可以使溶液由q点变到p点 |
D.加入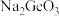 可以使溶液由n点变到m点 可以使溶液由n点变到m点 |
您最近一年使用:0次
2023-09-01更新
|
1140次组卷
|
8卷引用:广西柳州高级中学2023-2024学年高三上学期10月月考化学试题
10 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,无色或白色棱形结晶或粉末。易溶于热水,微溶于冷水,不溶于醇。某实验小组用水合肼制取硫酸肼。
Ⅰ.水合肼的制取
N2H4·H2O(水合肼)为无色透明油状发烟液体,具有强还原性。原理为NaClO+2NH3=N2H4·H2O+NaCl,可能用到的实验装置如图所示:
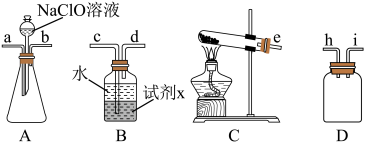
(1)装置C中发生反应的化学方程式是_______ 。
(2)装置的连接顺序是_______ (填仪器接口小写字母),试剂x可以是_______ (填写化学式,任写一种)。
(3)甲同学认为制取N2H4·H2O时,可以将氨气慢慢通入NaClO溶液中,乙同学认为不可以,乙同学认为不可以的理由是_______ 。
Ⅱ.制取硫酸肼
①将一定量水合肼加入到三口烧瓶内,将98%的浓硫酸加入滴液漏斗内,并缓慢滴加至三口烧瓶内,如图所示。
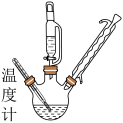
②保持烧瓶内温度在0~10℃左右,并用pH试纸测量其酸碱度,在pH值为5~7时可停止滴加。
③将溶液缓慢降温,缓慢搅拌然后保温2h,可沉降出白色固体。向混合溶液内加入适量甲醇,沉淀,过滤即可得硫酸肼固体。
(4)保持烧瓶内温度在0~10℃左右,可采用的方法是_______ 。
(5)反应结束后向混合溶液中加入甲醇的目的是_______ 。
(6)水合肼的纯度对制取硫酸肼的质量影响较大。称取水合肼样品3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右)加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在_______ (填“酸式”或“碱式”)滴定管。
②下列能导致水合肼的含量测定结果偏高的是_______ 。(填标号)
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,水合肼(N2H4·H2O)的质量分数为_______ 。
Ⅰ.水合肼的制取
N2H4·H2O(水合肼)为无色透明油状发烟液体,具有强还原性。原理为NaClO+2NH3=N2H4·H2O+NaCl,可能用到的实验装置如图所示:

(1)装置C中发生反应的化学方程式是
(2)装置的连接顺序是
(3)甲同学认为制取N2H4·H2O时,可以将氨气慢慢通入NaClO溶液中,乙同学认为不可以,乙同学认为不可以的理由是
Ⅱ.制取硫酸肼
①将一定量水合肼加入到三口烧瓶内,将98%的浓硫酸加入滴液漏斗内,并缓慢滴加至三口烧瓶内,如图所示。

②保持烧瓶内温度在0~10℃左右,并用pH试纸测量其酸碱度,在pH值为5~7时可停止滴加。
③将溶液缓慢降温,缓慢搅拌然后保温2h,可沉降出白色固体。向混合溶液内加入适量甲醇,沉淀,过滤即可得硫酸肼固体。
(4)保持烧瓶内温度在0~10℃左右,可采用的方法是
(5)反应结束后向混合溶液中加入甲醇的目的是
(6)水合肼的纯度对制取硫酸肼的质量影响较大。称取水合肼样品3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右)加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在
②下列能导致水合肼的含量测定结果偏高的是
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
2023-06-19更新
|
257次组卷
|
2卷引用:广西柳州高级中学、南宁二中2023届高三5月联考化学试题



