名校
1 . 通过海水晾晒可得粗盐,粗盐除NaCl外,还含有 、
、 、
、 以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________ 。
(2)第②步操作的目的是除去粗盐中的___________ (填化学式,下同),第⑥步操作的目的是除去滤液中___________ 和___________ 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、 、
、 、
、___________ 和___________ 。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是___________ 。
(5)过量 溶液和过量
溶液和过量 溶液滴加顺序
溶液滴加顺序___________ (填可以或不可以)调换,理由是___________ 。
(6)写出第③步一定能发生的离子反应方程___________ 。
 、
、 、
、 以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、
 、
、 、
、(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
(5)过量
 溶液和过量
溶液和过量 溶液滴加顺序
溶液滴加顺序(6)写出第③步一定能发生的离子反应方程
您最近一年使用:0次
2023-10-12更新
|
129次组卷
|
3卷引用:广西柳州铁一中学2023-2024学年高一上学期段考化学试卷
2 . 以闪锌矿( ,含有
,含有 和少量
和少量 、
、 、
、 杂质)为原料制备金属锌的流程如图所示:
杂质)为原料制备金属锌的流程如图所示:

相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
下列说法错误的是
 ,含有
,含有 和少量
和少量 、
、 、
、 杂质)为原料制备金属锌的流程如图所示:
杂质)为原料制备金属锌的流程如图所示:
相关金属离子[
 ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
A.“气体”主要是 | B.“调pH”的范围是2.8~7.4 |
C.通入 的目的是将 的目的是将 氧化为 氧化为 | D.“滤渣3”的主要成分是Cd |
您最近一年使用:0次
名校
解题方法
3 . 高纯氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(含磷酸盐、硅酸盐、铁、铅等)制备高纯氯化锰的工艺流程如图所示(部分操作和条件略)。
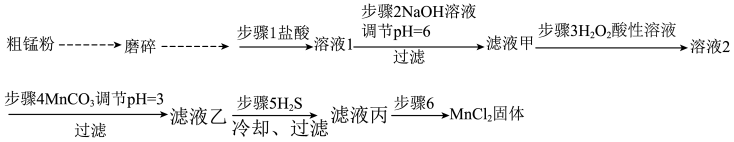
已知:生成氢氧化物沉淀的pH:
注:金属离子的起始浓度为0.1mol•L﹣1;当离子的浓度小于等于10﹣5mol•L﹣1时沉淀完全。
回答下列问题:
(1)将粗锰粉磨碎的目的是___________ 。
(2)步骤1和步骤2除去了磷酸盐和硅酸盐。非金属性P___________ Si(填写“大于”“小于”),从原子结构角度解释非金属性不同的原因是 ___________ 。
(3)所得滤液甲中的金属离子主要含有Mn2+、Fe2+和Pb2+等,且Pb2+不被H2O2氧化。加入H2O2目的是___________ 。(用离子方程式表示)。步骤4加入MnCO3得到沉淀的主要成分是 ___________ 。
(4)已知PbS的Ksp=8×10﹣28,MnS的Ksp=2×10﹣10.步骤5的目的是除去Pb2+,反应的离子方程式是___________ ,为了保证Pb2+除尽,控制溶液中S2﹣浓度范围是 ___________ 。(假设溶液中Mn2+、Pb2+的浓度是0.1mol•L﹣1)
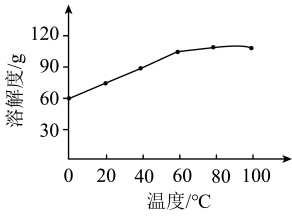
(5)已知;氯化锰的溶解度随温度的变化如图。步骤6的操作是___________ 、___________ 、过滤、洗涤、烘干。

已知:生成氢氧化物沉淀的pH:
| Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Pb(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 8.1 | 6.5 |
| 完全沉淀时 | 8.3 | 2.8 | 10.1 | 8.5 |
回答下列问题:
(1)将粗锰粉磨碎的目的是
(2)步骤1和步骤2除去了磷酸盐和硅酸盐。非金属性P
(3)所得滤液甲中的金属离子主要含有Mn2+、Fe2+和Pb2+等,且Pb2+不被H2O2氧化。加入H2O2目的是
(4)已知PbS的Ksp=8×10﹣28,MnS的Ksp=2×10﹣10.步骤5的目的是除去Pb2+,反应的离子方程式是
(5)已知;氯化锰的溶解度随温度的变化如图。步骤6的操作是

您最近一年使用:0次
名校
解题方法
4 . 门捷列夫最早预言了具有半导体特性类硅元素锗(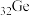 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
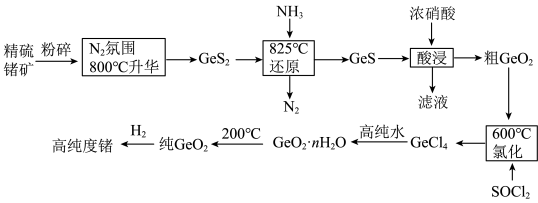
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②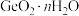 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。
(1)基态锗原子的价层电子排布式为___________ ,晶体锗的晶体类型是___________ 。
(2)800℃,使精硫锗矿在 氛围中升华的原因:
氛围中升华的原因:___________ 。
(3)还原时发生反应: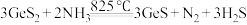 ,比较键角:
,比较键角:
___________  (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)___________ 。
(4)酸浸时温度不能过高的原因:___________ 。
(5)氯化除生成 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:___________ 。
(6) 水解得到
水解得到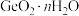 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是___________ 。
(7) 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
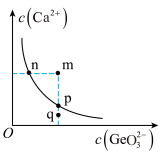
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
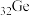 ),工业上用精硫锗矿(主要成分为
),工业上用精硫锗矿(主要成分为 )制取高纯度锗,其工艺流程如图所示:
)制取高纯度锗,其工艺流程如图所示:
已知:①硅和锗是同主族相邻元素,结构和性质类似;
②
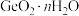 在5.3
在5.3  的盐酸中溶解度最小。
的盐酸中溶解度最小。(1)基态锗原子的价层电子排布式为
(2)800℃,使精硫锗矿在
 氛围中升华的原因:
氛围中升华的原因:(3)还原时发生反应:
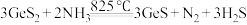 ,比较键角:
,比较键角:
 (填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)
(填“>”“<”或“=”),其原因是(从杂化和价层电子对互斥角度解释)(4)酸浸时温度不能过高的原因:
(5)氯化除生成
 外,反应还生成一种V形分子,写出相应的化学方程式:
外,反应还生成一种V形分子,写出相应的化学方程式:(6)
 水解得到
水解得到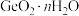 ,该步骤高纯水不能过量,原因是
,该步骤高纯水不能过量,原因是(7)
 与碱反应可生成锗酸盐,其中
与碱反应可生成锗酸盐,其中 是一种难溶电解质,一定温度下,
是一种难溶电解质,一定温度下, 在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是___________(填标号)。
A.n点与p点对应的 相等 相等 |
B.q点无 沉淀生成 沉淀生成 |
| C.通过蒸发可以使溶液由q点变到p点 |
D.加入 可以使溶液由n点变到m点 可以使溶液由n点变到m点 |
您最近一年使用:0次
2023-09-01更新
|
1139次组卷
|
8卷引用:广西柳州高级中学2023-2024学年高三上学期10月月考化学试题
5 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,无色或白色棱形结晶或粉末。易溶于热水,微溶于冷水,不溶于醇。某实验小组用水合肼制取硫酸肼。
Ⅰ.水合肼的制取
N2H4·H2O(水合肼)为无色透明油状发烟液体,具有强还原性。原理为NaClO+2NH3=N2H4·H2O+NaCl,可能用到的实验装置如图所示:
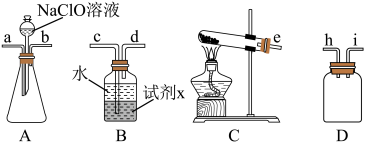
(1)装置C中发生反应的化学方程式是_______ 。
(2)装置的连接顺序是_______ (填仪器接口小写字母),试剂x可以是_______ (填写化学式,任写一种)。
(3)甲同学认为制取N2H4·H2O时,可以将氨气慢慢通入NaClO溶液中,乙同学认为不可以,乙同学认为不可以的理由是_______ 。
Ⅱ.制取硫酸肼
①将一定量水合肼加入到三口烧瓶内,将98%的浓硫酸加入滴液漏斗内,并缓慢滴加至三口烧瓶内,如图所示。
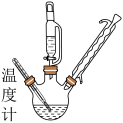
②保持烧瓶内温度在0~10℃左右,并用pH试纸测量其酸碱度,在pH值为5~7时可停止滴加。
③将溶液缓慢降温,缓慢搅拌然后保温2h,可沉降出白色固体。向混合溶液内加入适量甲醇,沉淀,过滤即可得硫酸肼固体。
(4)保持烧瓶内温度在0~10℃左右,可采用的方法是_______ 。
(5)反应结束后向混合溶液中加入甲醇的目的是_______ 。
(6)水合肼的纯度对制取硫酸肼的质量影响较大。称取水合肼样品3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右)加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在_______ (填“酸式”或“碱式”)滴定管。
②下列能导致水合肼的含量测定结果偏高的是_______ 。(填标号)
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,水合肼(N2H4·H2O)的质量分数为_______ 。
Ⅰ.水合肼的制取
N2H4·H2O(水合肼)为无色透明油状发烟液体,具有强还原性。原理为NaClO+2NH3=N2H4·H2O+NaCl,可能用到的实验装置如图所示:

(1)装置C中发生反应的化学方程式是
(2)装置的连接顺序是
(3)甲同学认为制取N2H4·H2O时,可以将氨气慢慢通入NaClO溶液中,乙同学认为不可以,乙同学认为不可以的理由是
Ⅱ.制取硫酸肼
①将一定量水合肼加入到三口烧瓶内,将98%的浓硫酸加入滴液漏斗内,并缓慢滴加至三口烧瓶内,如图所示。

②保持烧瓶内温度在0~10℃左右,并用pH试纸测量其酸碱度,在pH值为5~7时可停止滴加。
③将溶液缓慢降温,缓慢搅拌然后保温2h,可沉降出白色固体。向混合溶液内加入适量甲醇,沉淀,过滤即可得硫酸肼固体。
(4)保持烧瓶内温度在0~10℃左右,可采用的方法是
(5)反应结束后向混合溶液中加入甲醇的目的是
(6)水合肼的纯度对制取硫酸肼的质量影响较大。称取水合肼样品3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右)加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在
②下列能导致水合肼的含量测定结果偏高的是
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
2023-06-19更新
|
257次组卷
|
2卷引用:广西柳州高级中学、南宁二中2023届高三5月联考化学试题
6 . 利用熔融碱焙烧工艺可从铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工艺流程如下:
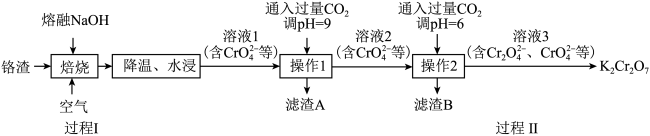
(1)为加快“水浸”速率,可采取的措施为
(2)操作1中通入过量
 调节pH,写出反应的离子方程式
调节pH,写出反应的离子方程式(3)过程Ⅰ中焙烧生成Na2CrO4的化学方程式为
(4)K2Cr2O7不同温度下溶解度(g/100gH2O)如下表:
| 化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
结合表中数据分析,过程得到K2Cr2O7粗品的操作是:向滤液3中加入稀盐酸和氯化钾后,
(5)实验室通常用氧化还原滴定测定K2Cr2O7产品纯度:氧化还原滴定与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
①用
②排出碱式滴定管中气泡的方法应采用如图操作中的
A. B.
B. C.
C. D.
D.
③某小组在滴定开始和结束时,装有标准液的滴定管液面如图所示,则本次滴定所消耗标准液的体积为

④若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则会使测定结果
您最近一年使用:0次
2023-03-05更新
|
252次组卷
|
2卷引用:广西柳州市民族高中2023-2024学年高二上学期期末复习卷一
名校
解题方法
7 . 实验室中用山梨酸和乙醇催化合成山梨酸乙酯的过程如下所示,下列说法错误的是
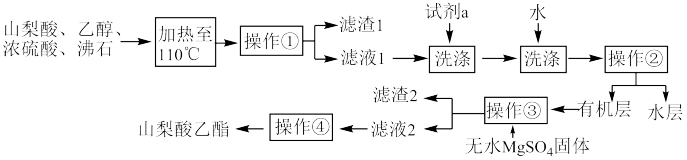

| A.反应时不能用水浴进行加热 |
| B.试剂a可以是5%NaOH溶液,目的是除去滤液1中的山梨酸和硫酸杂质 |
| C.操作①和操作③基本原理相同,操作②和操作④基本原理不同 |
| D.加入无水MgSO4固体的目的是除去有机物中的水分 |
您最近一年使用:0次
2023-02-21更新
|
1445次组卷
|
13卷引用:广西柳州高级中学2023-2024学年高三上学期10月月考化学试题
广西柳州高级中学2023-2024学年高三上学期10月月考化学试题山东省威海市2022-2023学年高三上学期期末考试化学试题江西省赣州市重点中学九校联盟2022-2023学年高二下学期第一次月考化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题6-10)(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖南省名校大联考2024届高三上学期第一次质量检测化学试题湖南四大名校2024届高三上学期第一次联考化学试题湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题湖南省炎德英才联考2024届高三上学期第一次质量检测化学试题江西省宜春市宜丰中学创新部2023-2024学年高三上学期第一次月考化学试题河南省兰考县第一高级中学2023-2024学年高二上学期期中考试化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高三上学期第一次质量检测化学试题福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题
名校
解题方法
8 . 刚玉在工业上有广泛的用途,其主要成分为 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量杂质
,含少量杂质 、FeO、
、FeO、 )制备刚玉的工艺流程如下:
)制备刚玉的工艺流程如下: 是酸性氧化物,且不与水反应。
是酸性氧化物,且不与水反应。
回答下列问题:
(1)滤渣的主要成分是_____ (填化学式);过滤时用到的玻璃仪器有漏斗、烧杯和______ 。
(2)“氧化”操作的目的为_______ ,该过程中发生反应的离子方程式为_______ 。
(3)已知:生成氢氧化物沉淀的pH如下表所示。
用氨水“调节pH”,pH的范围是_______ 。
(4)写出用氨水调节pH生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
(5)往 中滴加NaOH溶液,可以看到沉淀溶解,写出反应的化学方程式:
中滴加NaOH溶液,可以看到沉淀溶解,写出反应的化学方程式:_______ 。
 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量杂质
,含少量杂质 、FeO、
、FeO、 )制备刚玉的工艺流程如下:
)制备刚玉的工艺流程如下:
 是酸性氧化物,且不与水反应。
是酸性氧化物,且不与水反应。回答下列问题:
(1)滤渣的主要成分是
(2)“氧化”操作的目的为
(3)已知:生成氢氧化物沉淀的pH如下表所示。
| 氢氧化物 |  |  |  |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)写出用氨水调节pH生成
 沉淀的离子方程式:
沉淀的离子方程式:(5)往
 中滴加NaOH溶液,可以看到沉淀溶解,写出反应的化学方程式:
中滴加NaOH溶液,可以看到沉淀溶解,写出反应的化学方程式:
您最近一年使用:0次
2023-01-06更新
|
138次组卷
|
3卷引用:广西柳州高级中学2023-2024学年高一上学期寒假月考四化学试题
名校
9 . 羟基氧化镍 常作为锌镍电池的正极活性物质,也是重要的化工原料。工业上用含NiO的废料(杂质为
常作为锌镍电池的正极活性物质,也是重要的化工原料。工业上用含NiO的废料(杂质为 、CaO、ZnO,CuO等)制备羟基氧化镍的一种工艺流程如下:
、CaO、ZnO,CuO等)制备羟基氧化镍的一种工艺流程如下:

已知:相关金属离子形成氢氧化物沉淀的pH如下表(各离子浓度均为 )。
)。
请回答下列问题:
(1)酸浸时需将废料粉碎,目的是_______ 。
(2)某实验小组用 的硫酸进行酸浸。绘制了如图:
的硫酸进行酸浸。绘制了如图:


①由图一可知,固液比与镍浸出率的关系是_______ 。
②由图二可知,酸浸时合适的浸出温度是_______ ℃左右,若温度过高,则滤渣1中有氢氧化镍产生。
(3)向滤液2中加入FeS是为了除去 ,
, 。当
。当 恰好沉淀完全时,
恰好沉淀完全时,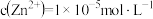 ,则
,则
_______  。[已知
。[已知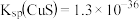 ,
, ]
]
(4)加入 溶液的作用是
溶液的作用是_______ 。试剂X用于调节溶液的pH,则应调节pH的范围是_______ 。
 常作为锌镍电池的正极活性物质,也是重要的化工原料。工业上用含NiO的废料(杂质为
常作为锌镍电池的正极活性物质,也是重要的化工原料。工业上用含NiO的废料(杂质为 、CaO、ZnO,CuO等)制备羟基氧化镍的一种工艺流程如下:
、CaO、ZnO,CuO等)制备羟基氧化镍的一种工艺流程如下:
已知:相关金属离子形成氢氧化物沉淀的pH如下表(各离子浓度均为
 )。
)。| 离子 |  |  |  |
| 开始沉淀的pH | 1.9 | 7.0 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.0 | 9.2 |
(1)酸浸时需将废料粉碎,目的是
(2)某实验小组用
 的硫酸进行酸浸。绘制了如图:
的硫酸进行酸浸。绘制了如图:

①由图一可知,固液比与镍浸出率的关系是
②由图二可知,酸浸时合适的浸出温度是
(3)向滤液2中加入FeS是为了除去
 ,
, 。当
。当 恰好沉淀完全时,
恰好沉淀完全时,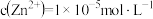 ,则
,则
 。[已知
。[已知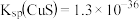 ,
, ]
](4)加入
 溶液的作用是
溶液的作用是
您最近一年使用:0次
10 . 以绿矾(主要成分为FeSO4·7H2O,部分Fe2+已被氧化为Fe3+)为原料,生产铁红(Fe2O3)的工艺流程如下:

(1)“转化”过程中,加入Fe粉的作用是___________ 。转化前将绿矾研碎,转化中进行搅拌和加热,目的是___________ 。
(2)“结晶”时,控制温度在75°C左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是___________ (填化学式)。

(3)“滤液”中的溶质为___________ (填化学式)。利用该滤液将工业废水中的Cr2O 还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3沉淀,理论上完全反应消耗的n(Cr2O
还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3沉淀,理论上完全反应消耗的n(Cr2O ):n(FeSO4)=
):n(FeSO4)=___________ 。
(4)“煅烧”过程中,每生成1mol铁红,需消耗___________ molO2,同时生成___________ molSO3和___________ molH2O。

(1)“转化”过程中,加入Fe粉的作用是
(2)“结晶”时,控制温度在75°C左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是

(3)“滤液”中的溶质为
 还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3沉淀,理论上完全反应消耗的n(Cr2O
还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3沉淀,理论上完全反应消耗的n(Cr2O ):n(FeSO4)=
):n(FeSO4)=(4)“煅烧”过程中,每生成1mol铁红,需消耗
您最近一年使用:0次
2022-03-16更新
|
162次组卷
|
2卷引用:广西柳州市鹿寨县鹿寨中学2021-2022学年高二上学期第三次统测化学试题



