名校
解题方法
1 . 金属镓被称为“电子工业脊梁”,GaN凭借其出色的功率性能、频率性能以及散热性能,不仅应用于5G技术中,也让高功率、更快速充电由渴望变为现实。
【方法一】工业上利用粉煤灰(主要成分为 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: mol/L时,可认为已除尽。
mol/L时,可认为已除尽。
(1)“焙烧”的主要目的是_______ 。
(2)“滤渣1”主要成分为_______ 。
(3)“二次酸化”中Na[Ga(OH4)]与过量 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“电解”可得金属Ga,写出阴极电极反应式_______ 。
(5)常温下,反应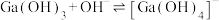 的平衡常数K的值为
的平衡常数K的值为_______ 。
【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成 无机聚合凝胶
无机聚合凝胶
失水缩聚: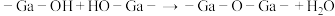
失醇缩聚:_______  (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)
(7)步骤二:高温氨化(原理: )
)
已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再_______ (补充实验操作),得到纯净的GaN粉末。
【方法一】工业上利用粉煤灰(主要成分为
 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: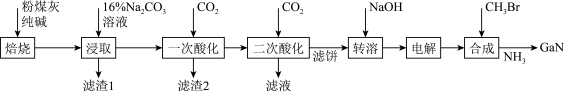
 mol/L时,可认为已除尽。
mol/L时,可认为已除尽。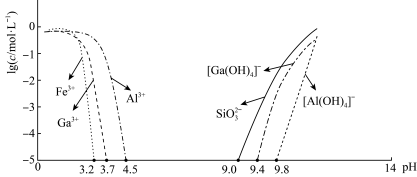
(1)“焙烧”的主要目的是
(2)“滤渣1”主要成分为
(3)“二次酸化”中Na[Ga(OH4)]与过量
 发生反应的离子方程式为
发生反应的离子方程式为(4)“电解”可得金属Ga,写出阴极电极反应式
(5)常温下,反应
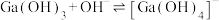 的平衡常数K的值为
的平衡常数K的值为【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成
 无机聚合凝胶
无机聚合凝胶失水缩聚:
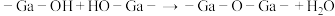
失醇缩聚:
 (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)(7)步骤二:高温氨化(原理:
 )
)已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将
 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
您最近一年使用:0次
2 . 锂和铍是重要的稀有金属元素,被国内外视为战略性资源。一种从尾矿(主要含 BeO、Li2O、SiO2及Fe、Al元素)中主要提取锂、铍、铝的工艺如下:
① C6H5COOH 熔点为 122℃ 微溶于水;
② Li+可与 FeCl 结合成LiFeCl4的形式被TBP萃取;
结合成LiFeCl4的形式被TBP萃取;
③ HCl (浓) + FeCl3 HFeCl4 (易溶于有机溶剂)。
HFeCl4 (易溶于有机溶剂)。
回答下列问题:
(1) “浸渣 ”的主要成分是_______ 。
(2) “氧化 ”步骤中控制反应的温度为 20℃ , 其原因是_______ 。
(3) “沉铁 ”步骤中加入 Na2SO4 发生反应的离子方程式为_______ 。
(4)若直接调节pH 进行沉铁、沉铝,会造成 Li+ 、Be2+ 损失的原因是_______ 。
(5) “萃取 ”步骤以TBP为萃取剂、FeCl3为协萃剂,还需加入NH4Cl的作用是_______ 。
(6) “反萃取 ”步骤中,最好选择_______ 作为反萃取剂。
(7) “操作 X ”的步骤:先_______ ,再固液分离。

① C6H5COOH 熔点为 122℃ 微溶于水;
② Li+可与 FeCl
 结合成LiFeCl4的形式被TBP萃取;
结合成LiFeCl4的形式被TBP萃取;③ HCl (浓) + FeCl3
 HFeCl4 (易溶于有机溶剂)。
HFeCl4 (易溶于有机溶剂)。回答下列问题:
(1) “浸渣 ”的主要成分是
(2) “氧化 ”步骤中控制反应的温度为 20℃ , 其原因是
(3) “沉铁 ”步骤中加入 Na2SO4 发生反应的离子方程式为
(4)若直接调节pH 进行沉铁、沉铝,会造成 Li+ 、Be2+ 损失的原因是
(5) “萃取 ”步骤以TBP为萃取剂、FeCl3为协萃剂,还需加入NH4Cl的作用是
(6) “反萃取 ”步骤中,最好选择
(7) “操作 X ”的步骤:先
您最近一年使用:0次
名校
解题方法
3 . 氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯如图所示(加热和固定仪器的装置略去)。
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是_______ (填序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是_______ 。
(3)仪器b的名称是_______ ,仪器c中冷凝水从_______ 进(填“上口”或“下口”),仪器c出口的气体成分是HCl、Cl2、水蒸气和_______ 。
(4)制取氯苯的化学方程式为_______ 。
(5)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要进行水洗,其目的是_______ 。
②10% NaOH溶液碱洗时发生氧化还原反应的离子反应方程式为_______ 。
(6)工业生产中苯的流失情况如表所示:
则10 t苯可制得成品氯苯_______ t。(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)
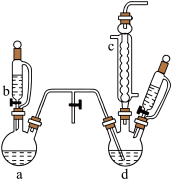
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是
(3)仪器b的名称是
(4)制取氯苯的化学方程式为
(5)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要进行水洗,其目的是
②10% NaOH溶液碱洗时发生氧化还原反应的离子反应方程式为
(6)工业生产中苯的流失情况如表所示:
| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量/(kg·t-1) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
您最近一年使用:0次
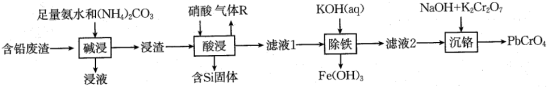
4 . 铬酸铅(PbCrO4)又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是PbSO4和ZnO,还含Fe3O4、SiO2等)为原料制备铬酸铅的流程如下:
②常温下,几种难溶电解质的溶度积如下:
回答下列问题:
(1)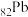 位于周期表第
位于周期表第___________ 周期___________ 族,PbCrO4中Cr的化合价为___________ 。
(2)“碱浸”中PbSO4转化反应的离子方程式为___________ 。
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为___________ 。
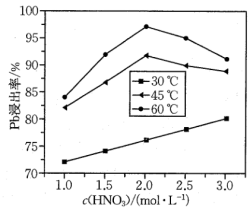
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为___________ 。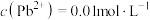 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为___________ 。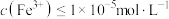 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。
(6)“沉铬”中生成PbCrO4反应的离子方程式为___________ 。
②常温下,几种难溶电解质的溶度积如下:
| 电解质 | PbCO3 | PbSO4 | PbCrO4 | Pb(OH)2 | Fe(OH)3 |
 | 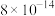 |  | 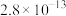 | 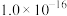 | 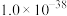 |
(1)
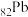 位于周期表第
位于周期表第(2)“碱浸”中PbSO4转化反应的离子方程式为
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为
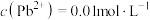 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为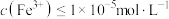 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。(6)“沉铬”中生成PbCrO4反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
75次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
5 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾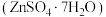 的工艺流程如下:
的工艺流程如下:
(1)为提高“酸浸”效率,可采取的措施有___________ (任写一条)。
(2)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤、干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性、含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属
,得到金属 和
和 的混合物,该混合物可表示为
的混合物,该混合物可表示为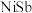 ,形成
,形成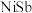 的离子方程式为
的离子方程式为___________ 。
(4)“浸渣”中含有 ,经一系列处理得
,经一系列处理得 (可溶于水,电离成
(可溶于水,电离成 和
和 ),用肼
),用肼 还原
还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(5)浸出液中含有 ,“沉铁”步骤中发生反应的离子方程式为
,“沉铁”步骤中发生反应的离子方程式为___________ 。 对不同金属沉出率的影响如图所示,则“沉铁”时最合理的pH约为
对不同金属沉出率的影响如图所示,则“沉铁”时最合理的pH约为___________ 。在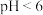 时,
时, 、
、 、
、 在溶液中以离子形式存在。但是有铁离子存在时pH升高,Zn、Cu、Ni损失率均升高,原因可能是
在溶液中以离子形式存在。但是有铁离子存在时pH升高,Zn、Cu、Ni损失率均升高,原因可能是___________ 。
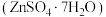 的工艺流程如下:
的工艺流程如下: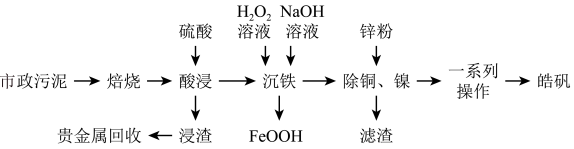
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性、含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 ,得到金属
,得到金属 和
和 的混合物,该混合物可表示为
的混合物,该混合物可表示为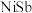 ,形成
,形成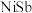 的离子方程式为
的离子方程式为(4)“浸渣”中含有
 ,经一系列处理得
,经一系列处理得 (可溶于水,电离成
(可溶于水,电离成 和
和 ),用肼
),用肼 还原
还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为(5)浸出液中含有
 ,“沉铁”步骤中发生反应的离子方程式为
,“沉铁”步骤中发生反应的离子方程式为 对不同金属沉出率的影响如图所示,则“沉铁”时最合理的pH约为
对不同金属沉出率的影响如图所示,则“沉铁”时最合理的pH约为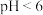 时,
时, 、
、 、
、 在溶液中以离子形式存在。但是有铁离子存在时pH升高,Zn、Cu、Ni损失率均升高,原因可能是
在溶液中以离子形式存在。但是有铁离子存在时pH升高,Zn、Cu、Ni损失率均升高,原因可能是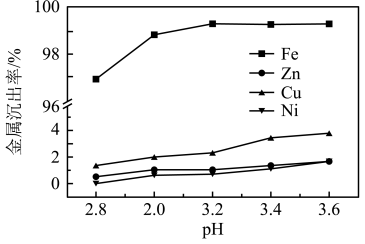
您最近一年使用:0次
解题方法
6 . 锌在冶金、化学电源等方面具有重要作用,是一种应用广泛的金属。以闪锌矿(主要成分为 ,还含有
,还含有 和少量
和少量 杂质)为原料,制备金属锌的流程如图所示:
杂质)为原料,制备金属锌的流程如图所示:
(1)焙烧过程排放烟气中含有大量的 ,直接排放会污染空气,可用氧化锌吸收法除去。配制
,直接排放会污染空气,可用氧化锌吸收法除去。配制 悬浊液(含少量
悬浊液(含少量 、
、 ),在吸收塔中封闭循环脱硫,发生的主要反应为
),在吸收塔中封闭循环脱硫,发生的主要反应为 ,该反应常温下能自发进行的原因是
,该反应常温下能自发进行的原因是___________ 。
(2)用稀硫酸完全溶浸后,溶液中各离子浓度如下表
①“氧化除杂”工序中发生反应的离子方程式___________ 。
②常温下,有关离子沉淀的 如下表所示(当离子浓度为
如下表所示(当离子浓度为 时认为沉淀完全):
时认为沉淀完全):
则
___________ ,“氧化”后调 的范围是
的范围是___________ 。
(3)溶液中的
___________ (填“能”或“不能”)直接在“氧化除杂”步骤中除去,其原因是___________ 。
(4)电解硫酸锌溶液制备单质锌时,电解总方程式为___________ ;沉积锌后的电解液可返回___________ 工序继续使用。
(5)下列金属冶炼的方法与本工艺电解冶炼锌方法相似的是___________。
 ,还含有
,还含有 和少量
和少量 杂质)为原料,制备金属锌的流程如图所示:
杂质)为原料,制备金属锌的流程如图所示: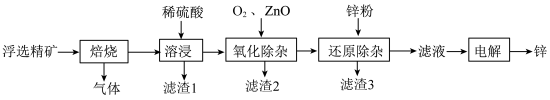
(1)焙烧过程排放烟气中含有大量的
 ,直接排放会污染空气,可用氧化锌吸收法除去。配制
,直接排放会污染空气,可用氧化锌吸收法除去。配制 悬浊液(含少量
悬浊液(含少量 、
、 ),在吸收塔中封闭循环脱硫,发生的主要反应为
),在吸收塔中封闭循环脱硫,发生的主要反应为 ,该反应常温下能自发进行的原因是
,该反应常温下能自发进行的原因是(2)用稀硫酸完全溶浸后,溶液中各离子浓度如下表
| 金属离子 |  |  |  |  |
浓度( ) ) | 1.0 | 0.01 | 1.0 | 0.01 |
②常温下,有关离子沉淀的
 如下表所示(当离子浓度为
如下表所示(当离子浓度为 时认为沉淀完全):
时认为沉淀完全): |  |  | |
开始沉淀 | 2.3 | 6.2 | 7.4 |
沉淀完全 | x | 8.7 | 9.4 |

 的范围是
的范围是(3)溶液中的

(4)电解硫酸锌溶液制备单质锌时,电解总方程式为
(5)下列金属冶炼的方法与本工艺电解冶炼锌方法相似的是___________。
| A.电解熔融的氯化钠制钠 | B.电解熔融的氯化镁制镁 |
| C.电解熔融的氧化铝制铝 | D.电镀硫酸铜废水回收金属铜 |
您最近一年使用:0次
名校
解题方法
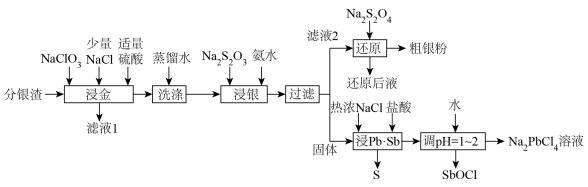
7 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近一年使用:0次
名校
8 . 实验室以液态环己醇( )为原料制取己二酸[HOOC(CH2)4COOH]晶体的实验流程如图:
)为原料制取己二酸[HOOC(CH2)4COOH]晶体的实验流程如图:

反应原理: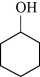

 HOOC(CH2)4COOH
HOOC(CH2)4COOH
| 温度/℃ | 15 | 25 | 50 | 70 | 100 |
| 溶解度/g | 1.44 | 2.3 | 8.48 | 34.1 | 160 |
环己醇被高锰酸钾氧化时的实验装置如图,请回答:
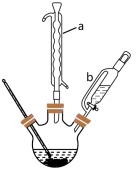
②用仪器b滴加环己醇时,需逐滴加入的原因是
③若发现b中有环己醇残留偏多,可以向b中加入
(2)加盐酸的目的是
(3)用重结晶法提纯己二酸,提纯过程中需要用活性炭脱色,请从下列选项中选合理的操作并排序:
b→(___________)→(___________)→(___________)→e。
a.冷却至室温,过滤
b.把粗产品配成热的浓溶液
c.趁热过滤
d.加入活性炭脱色
e.干燥
(4)己二酸纯度测定
将0.5000g己二酸样品配制成100mL溶液,每次取25.00mL试样溶液于锥形瓶中,滴入几滴酚酞试液,用0.1000mol/LNaOH溶液滴定至终点,平均消耗NaOH溶液16.00mL(己二酸被完全中和)。
①下列说法正确的是
A.用100mL容量瓶配制成溶液后,最好用25mL规格的量筒量取待测液于锥形瓶中
B.润洗滴定管时,待液体润湿全部滴定管内壁后,应将液体从滴定管上口倒入预置的烧杯中
C.接近滴定终点时,应控制活塞,改为滴加一滴标准溶液,直至溶液变为粉红色,且半分钟内不变色
D.若滴定前滴定管尖嘴部分气泡未赶走,滴定后气泡消失,则测定结果偏高
②己二酸的纯度为
您最近一年使用:0次
名校
解题方法
9 . 铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下图:
的工艺流程如下图:
ⅰ. 易水解;
易水解; 难溶于冷水
难溶于冷水
ⅱ.“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质
,硫元素转化为硫单质
ⅲ.

ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)“氧化浸取”前将辉铋矿粉碎的目的是______ 。
(2)“滤渣1”的主要成分为S和______ (填化学式)。
(3)“氧化浸取”步骤中温度升高可以增大反应速率,但高于50℃时浸取速率反而会下降,其可能的原因是______ 、______ 。
(4)“除铁”时,调节溶液pH的范围是______ 。
(5)“除铜”时发生反应: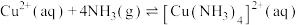
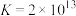 ,则
,则
______ 。
(6)“转化”时,生成 的离子方程式为
的离子方程式为______ ;“转化”后应冷却至室温再过滤,原因是______ 。
 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下图:
的工艺流程如下图: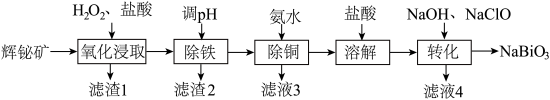
ⅰ.
 易水解;
易水解; 难溶于冷水
难溶于冷水ⅱ.“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质
,硫元素转化为硫单质ⅲ.


ⅳ.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)“氧化浸取”前将辉铋矿粉碎的目的是
(2)“滤渣1”的主要成分为S和
(3)“氧化浸取”步骤中温度升高可以增大反应速率,但高于50℃时浸取速率反而会下降,其可能的原因是
(4)“除铁”时,调节溶液pH的范围是
(5)“除铜”时发生反应:
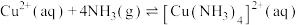
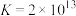 ,则
,则
(6)“转化”时,生成
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-04-07更新
|
259次组卷
|
3卷引用:宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题
名校
解题方法
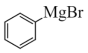
10 . 三苯甲醇( )(Mr=260)是一种重要的有机合成中间体,某实验小组利用格氏试剂(
)(Mr=260)是一种重要的有机合成中间体,某实验小组利用格氏试剂(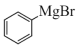 )制备三苯甲醇。
)制备三苯甲醇。
已知:i.格氏试剂非常活泼,遇水剧烈反应,其制备原理 +Mg
+Mg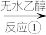
 ;
;
ii.相关物质的物理性质如下表所示。
实验步骤如下:
步骤I.合成格氏试剂
向仪器X中加入1.44g(0.06mol)镁屑和1小粒碘,装好装置,向仪器Y中加入12.0mL溴苯(0.10mol)和25.00mL乙醚,混匀,开始缓慢滴入仪器X中,反应中保持微沸,直至Mg完全反应,反应后溶液待用。
步骤Ⅱ.制备三苯甲醇
将仪器X置于冰水浴中,加入3mL(0.02mol)苯甲酸乙酯( )和20mL无水乙醚的混合液,温水浴回流反应0.5h,生成
)和20mL无水乙醚的混合液,温水浴回流反应0.5h,生成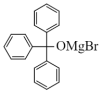 ,冷却后加入饱和氯化铵溶液。将反应装置改装,回收乙醚并除去未反应的溴苯和其他副产物,三苯甲醇变为固体析出,抽滤,用石油醚洗涤,干燥得粗产品,经提纯后得到产品3.5g。
,冷却后加入饱和氯化铵溶液。将反应装置改装,回收乙醚并除去未反应的溴苯和其他副产物,三苯甲醇变为固体析出,抽滤,用石油醚洗涤,干燥得粗产品,经提纯后得到产品3.5g。
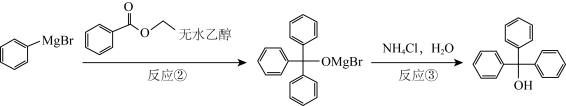
注:反应②中,苯甲酸乙酯与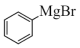 以物质的量之比为1:2反应。
以物质的量之比为1:2反应。
回答下列问题:
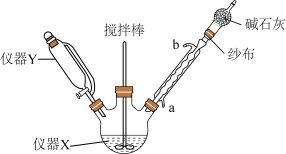
(1)仪器Y的名称为_______ ;干燥管中塞入的纱布的作用为_______ ,碱石灰的作用为_______ ;球形冷凝管的进水口是_______ (填“a”或“b”)口。
(2)制备格氏试剂时,加入一小粒碘可加快反应速率,推测 对反应①活化能的影响是
对反应①活化能的影响是_______ (填“升高”“降低”或“不变”)。
(3)回收乙醚时需将装置改装为_______ (填选项字母)装置;回收时不能使用明火加热的原因为_______ 。
A.萃取 B.蒸馏 C.过滤 D.重结晶
(4)该实验中三苯甲醇的产率为_______ (保留三位有效数字)。
 )(Mr=260)是一种重要的有机合成中间体,某实验小组利用格氏试剂(
)(Mr=260)是一种重要的有机合成中间体,某实验小组利用格氏试剂( )制备三苯甲醇。
)制备三苯甲醇。已知:i.格氏试剂非常活泼,遇水剧烈反应,其制备原理
 +Mg
+Mg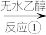
 ;
;ii.相关物质的物理性质如下表所示。
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 三苯甲醇 | 164.2 | 380 | 不溶于水,易溶于乙醚 |
| 乙醚 | -116.2 | 34.6 | 微溶于水,易溶于乙醇等 |
| 溴苯 | -30.7 | 156.2 | 不溶于水,易溶于乙醚 |
| 苯甲酸乙酯 | -34.6 | 212.6 | 不溶于水,易溶于乙醚 |
步骤I.合成格氏试剂
向仪器X中加入1.44g(0.06mol)镁屑和1小粒碘,装好装置,向仪器Y中加入12.0mL溴苯(0.10mol)和25.00mL乙醚,混匀,开始缓慢滴入仪器X中,反应中保持微沸,直至Mg完全反应,反应后溶液待用。

步骤Ⅱ.制备三苯甲醇
将仪器X置于冰水浴中,加入3mL(0.02mol)苯甲酸乙酯(
 )和20mL无水乙醚的混合液,温水浴回流反应0.5h,生成
)和20mL无水乙醚的混合液,温水浴回流反应0.5h,生成 ,冷却后加入饱和氯化铵溶液。将反应装置改装,回收乙醚并除去未反应的溴苯和其他副产物,三苯甲醇变为固体析出,抽滤,用石油醚洗涤,干燥得粗产品,经提纯后得到产品3.5g。
,冷却后加入饱和氯化铵溶液。将反应装置改装,回收乙醚并除去未反应的溴苯和其他副产物,三苯甲醇变为固体析出,抽滤,用石油醚洗涤,干燥得粗产品,经提纯后得到产品3.5g。
注:反应②中,苯甲酸乙酯与
 以物质的量之比为1:2反应。
以物质的量之比为1:2反应。回答下列问题:
(1)仪器Y的名称为
(2)制备格氏试剂时,加入一小粒碘可加快反应速率,推测
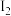 对反应①活化能的影响是
对反应①活化能的影响是(3)回收乙醚时需将装置改装为
A.萃取 B.蒸馏 C.过滤 D.重结晶
(4)该实验中三苯甲醇的产率为
您最近一年使用:0次




