名校
1 . 闽盐集团晾晒海水获得的粗盐中含有可溶性杂质 、
、 、
、 等。粗盐提纯的工艺流程如下,下列说法正确的是
等。粗盐提纯的工艺流程如下,下列说法正确的是
 、
、 、
、 等。粗盐提纯的工艺流程如下,下列说法正确的是
等。粗盐提纯的工艺流程如下,下列说法正确的是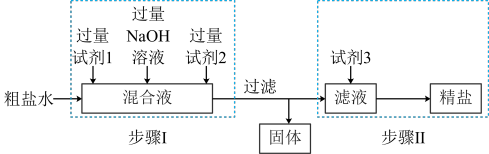
A.“步骤Ⅰ”中试剂1为 溶液,试剂2为 溶液,试剂2为 溶液 溶液 |
| B.“步骤Ⅰ”生成的沉淀也可在加完试剂3之后一次性过滤 |
| C.“步骤Ⅱ”试剂3可以用稀硫酸代替稀盐酸 |
| D.“步骤Ⅱ”从滤液中获得精盐的方法是蒸发结晶 |
您最近一年使用:0次
名校
2 . 海水资源非常丰富。某化学实验小组同学为了从海带中提取碘和海水提溴,进行以下实验:
Ⅰ.从海带中提取碘单质,实验流程图如下:
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。
(2)步骤④中使用稀硫酸和 溶液能更有利于提取碘,写出离子方程式
溶液能更有利于提取碘,写出离子方程式___________ 。
(3)步骤⑤中用分液漏斗得到碘的四氮化碳溶液,其操作顺序是___________ (填字母)。___________ 。
Ⅱ.海水中主要离子的含量如下:
(5)利用海水可以提取溴和镁,提取过程如下: 溶液中得到
溶液中得到 晶体的主要实验操作是
晶体的主要实验操作是___________ 、洗涤、烘干。从 晶体中得到无水
晶体中得到无水 的主要方法是
的主要方法是___________ 。
②用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为___________ 。
③依据上述流程,若将5 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为___________ L(忽略 溶解)。
溶解)。
Ⅰ.从海带中提取碘单质,实验流程图如下:
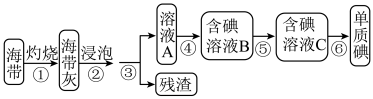
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)步骤④中使用稀硫酸和
 溶液能更有利于提取碘,写出离子方程式
溶液能更有利于提取碘,写出离子方程式(3)步骤⑤中用分液漏斗得到碘的四氮化碳溶液,其操作顺序是
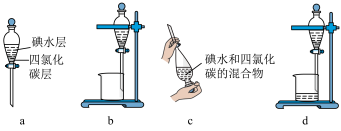
Ⅱ.海水中主要离子的含量如下:
| 成分 |  |  |  |  |  |  |  |
含量/( ) ) | 18980 | 10560 | 2560 | 1272 | 400 | 142 | 64 |
(5)利用海水可以提取溴和镁,提取过程如下:
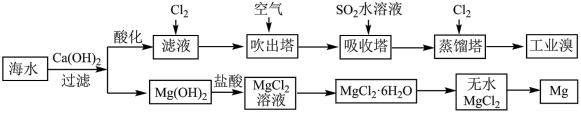
 溶液中得到
溶液中得到 晶体的主要实验操作是
晶体的主要实验操作是 晶体中得到无水
晶体中得到无水 的主要方法是
的主要方法是②用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为③依据上述流程,若将5
 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为 溶解)。
溶解)。
您最近一年使用:0次
名校
3 . 高锰酸钾生产过程中产生的废锰渣(主要成分为 、
、 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
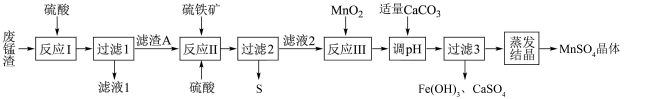
已知:硫铁矿的主要成分为二硫化亚铁( ,杂质不参与反应)。
,杂质不参与反应)。
回答下列问题:
(1)二硫化亚铁中S元素的化合价为_______ 。
(2)①滤渣A的主要成分是_______ (填化学式);
②“反应II”生成 、
、 等物质的离子方程式为
等物质的离子方程式为_______ 。
③“反应III”中还原剂和氧化剂物质的量之比为_______ ;
④“调 ”时,验证
”时,验证 已经沉淀完全的实验操作和现象为
已经沉淀完全的实验操作和现象为_______ 。
 、
、 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
已知:硫铁矿的主要成分为二硫化亚铁(
 ,杂质不参与反应)。
,杂质不参与反应)。回答下列问题:
(1)二硫化亚铁中S元素的化合价为
(2)①滤渣A的主要成分是
②“反应II”生成
 、
、 等物质的离子方程式为
等物质的离子方程式为③“反应III”中还原剂和氧化剂物质的量之比为
④“调
 ”时,验证
”时,验证 已经沉淀完全的实验操作和现象为
已经沉淀完全的实验操作和现象为
您最近一年使用:0次
名校
4 . 化工产品中,含氯物质众多,其用途广泛。回答下列问题:
(1)如图为氯及其化合物的“价-类”二维图。缺失的物质B为_______ (填化学式)。

(2)次氯酸钠是一种含氯物质,取含次氯酸钠14.9g/L的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol/L。
(3)电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:

已知:Ca(ClO3)2易溶于水。
①“一系列操作”为_______ 、_______ 。
②“转化”发生反应的离子方程式为_______ 。
(1)如图为氯及其化合物的“价-类”二维图。缺失的物质B为

(2)次氯酸钠是一种含氯物质,取含次氯酸钠14.9g/L的“84”消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
(3)电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:

已知:Ca(ClO3)2易溶于水。
①“一系列操作”为
②“转化”发生反应的离子方程式为
您最近一年使用:0次
名校
5 . 氯化亚铜(CuCl)难溶于醇和水,在潮湿空气中易水解氧化,广泛应用于冶金工业,以铜为原料生产 的流程如下:
的流程如下:错误 的是
 的流程如下:
的流程如下: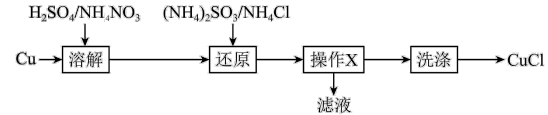
A.“溶解”时可能发生的反应: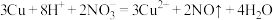 |
B.“还原”反应的氧化产物是 或 或 |
| C.“操作X”是过滤 |
| D.“洗涤”时先用硝酸洗,再用乙醇洗 |
您最近一年使用:0次
2024-03-14更新
|
532次组卷
|
4卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题
6 . 某工厂的工业废水中含有大量的 、较多量的
、较多量的 和
和 ,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀
,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀 、NaOH溶液)
、NaOH溶液)

(1)若废水是由 、
、 和
和 组成的混合溶液,其中
组成的混合溶液,其中 ,
, ,
, ,(溶液中
,(溶液中 和
和 浓度忽略不计),则
浓度忽略不计),则 为
为________  。
。
(2)试剂①是________ 。
(3)固体E的成分是________ (填化学式),操作c名称为________ 。
(4)若取2mL溶液D加入试管中,然后向其中滴加氢氧化钠溶液,可观察到的现象是________ ,此过程中涉及氧化还原反应的化学方程式是________ 。
(5)回收的 经一系列变化后可制得一种新型绿色净水剂高铁酸钠
经一系列变化后可制得一种新型绿色净水剂高铁酸钠 ,主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:
,主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:_____
________ ________
________ ________
________ ________
________ ________
________ ________
________ ,
,
当有 生成时,转移电子的数目约为
生成时,转移电子的数目约为________ 个。
 、较多量的
、较多量的 和
和 ,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀
,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀 、NaOH溶液)
、NaOH溶液)
(1)若废水是由
 、
、 和
和 组成的混合溶液,其中
组成的混合溶液,其中 ,
, ,
, ,(溶液中
,(溶液中 和
和 浓度忽略不计),则
浓度忽略不计),则 为
为 。
。(2)试剂①是
(3)固体E的成分是
(4)若取2mL溶液D加入试管中,然后向其中滴加氢氧化钠溶液,可观察到的现象是
(5)回收的
 经一系列变化后可制得一种新型绿色净水剂高铁酸钠
经一系列变化后可制得一种新型绿色净水剂高铁酸钠 ,主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:
,主要用于饮用水处理。其中一种制备原理如下,请配平该反应的离子方程式:________
 ________
________ ________
________ ________
________ ________
________ ________
________ ,
,当有
 生成时,转移电子的数目约为
生成时,转移电子的数目约为
您最近一年使用:0次
2024-02-03更新
|
123次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高一上学期期末教学质量检测化学试卷
7 . 某废旧金属材料中主要含Fe、Cu、Al、 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去_______ 。
(2)“碱浸”时发生反应的化学方程式为_______ 。
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______ 。
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为_______ 。
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为_______ 。
①设计实验检验滤液Ⅱ中是否含有上述离子:_______ 。
②若要定量测定所得绿矾纯度,可通过如下方法:称取 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为_______ 。(写出计算过程,结果保留三位有效数字)已知: (未配平)
(未配平)
 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。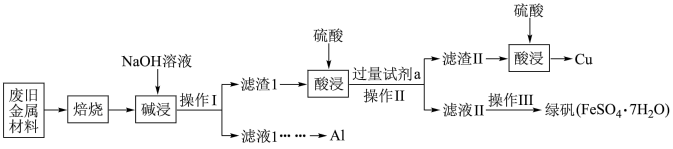
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的化学方程式为
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为
①设计实验检验滤液Ⅱ中是否含有上述离子:
②若要定量测定所得绿矾纯度,可通过如下方法:称取
 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为 (未配平)
(未配平)
您最近一年使用:0次
2023-07-28更新
|
446次组卷
|
2卷引用:内蒙古自治区乌海市第一中学2023-2024学年高一下学期4月第一次月考化学试题
名校
解题方法
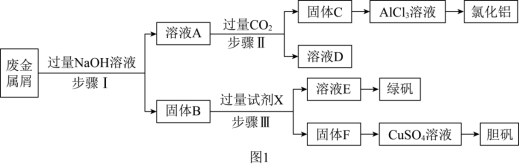
8 . 某工厂的废金属屑中主要成分为 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。
和胆矾晶体。
请回答下列问题:
(1)试剂X是_______ 。
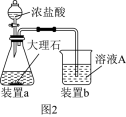
(2)在步骤Ⅱ过程,生成固体C发生的化学反应方程式为_______ ,若用如图 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是_______ 。
(3)检验溶液 中的金属阳离子时,滴加
中的金属阳离子时,滴加_______ ,溶液无明显现象,说明溶液中不存在Fe3+,用离子方程式解释其可能的原因_______ 。
(4)由绿矾晶体(FeSO4•7H2O)固体配制240mL 0.10mol•L-1FeSO4溶液,需要用到的仪器有药匙、玻璃棒、量筒、烧杯、托盘天平、胶头滴管、_______ 。以下操作会导致所配溶液浓度偏低的是_______ 。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体 和胆矾晶体。
和胆矾晶体。
请回答下列问题:
(1)试剂X是
(2)在步骤Ⅱ过程,生成固体C发生的化学反应方程式为
 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
(3)检验溶液
 中的金属阳离子时,滴加
中的金属阳离子时,滴加(4)由绿矾晶体(FeSO4•7H2O)固体配制240mL 0.10mol•L-1FeSO4溶液,需要用到的仪器有药匙、玻璃棒、量筒、烧杯、托盘天平、胶头滴管、
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
您最近一年使用:0次
2023-03-18更新
|
238次组卷
|
2卷引用:内蒙古鄂尔多斯市西四旗2023-2024学年高一上学期期末考试化学试题



