名校
1 . 粗盐中含有泥沙以及Ca2+、Mg2+、SO 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程:
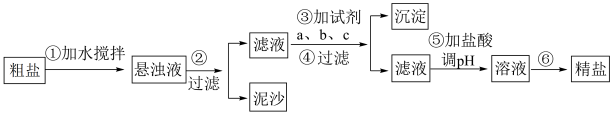
下列说法不正确的是
 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程:
下列说法不正确的是
| A.步骤⑥获得精盐的操作方法是蒸发结晶 |
| B.过滤时需要用到的玻璃仪器有烧杯、漏斗、玻璃棒 |
| C.加盐酸调溶液pH的目的只是为了除去过量的OH- |
| D.操作③按a、b、c顺序可依次加入过量的NaOH溶液、BaCl2溶液、Na2CO3溶液 |
您最近一年使用:0次
2021-11-11更新
|
357次组卷
|
5卷引用:黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题
黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题黑龙江省勃利县高级中学2022-2023学年高一上学期11月期中考试化学试题河南省郑州市十校2021-2022学年高一上学期期中联考化学试题甘肃省兰州第一中学2021-2022学年高一下学期4月月考化学试题(已下线)2.1.1 粗盐的提纯和氯碱工业-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
2 . NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
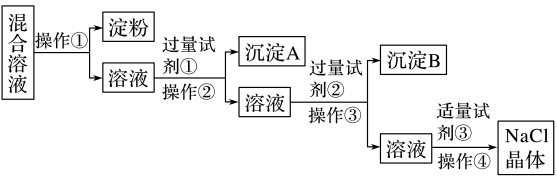
(1)写出上述实验过程中所用试剂(写化学式):试剂①_______ ;试剂③_______ 。
(2)判断试剂①已过量的方法是_______ 。
(3)用离子方程式表示加入试剂②的作用:_______ 。
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉_______ (填“能”或“不能”)透过半透膜;SO
_______ (填“能”或“不能”)透过半透膜。请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:1 mol·L-1 AgNO3溶液、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸

(1)写出上述实验过程中所用试剂(写化学式):试剂①
(2)判断试剂①已过量的方法是
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉

| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
您最近一年使用:0次
2021-10-18更新
|
383次组卷
|
6卷引用:黑龙江省齐齐哈尔市龙江县第一中学2021-2022学年高一9月月考化学试题
黑龙江省齐齐哈尔市龙江县第一中学2021-2022学年高一9月月考化学试题2015-2016学年安徽师大附属中学高一上期中测试化学试卷2016-2017学年广西陆川中学高一上期中化学卷【全国百强校】广东省佛山市第一中学2018-2019学年高一上学期第一次段考化学试题人教版(2019)高一必修第一册 第一章 物质及其变化 第二节 离子反应(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)
名校
解题方法
3 . 海带中含有碘元素,实验室从海带中提取碘的部分流程如图:

下列说法不正确的是
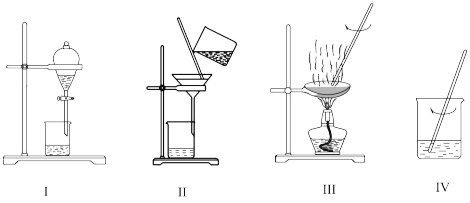

下列说法不正确的是

| A.完成步骤①需要装置Ⅲ |
| B.完成步骤③需要装置Ⅱ |
| C.步骤④反应的离子方程式为2I-+H2O2+2H+=2H2O+I2 |
| D.步骤⑤提取碘可以用有机溶剂CCl4 |
您最近一年使用:0次
2021-09-16更新
|
252次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学2021-2022学年高二上学期10月阶段性测试化学试题
4 . 某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是
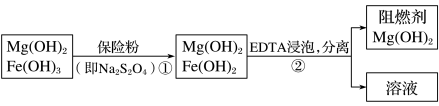

| A.步骤①中保险粉是作还原剂,步骤②中分离操作的名称是过滤 |
B.步骤①中的反应式:3Fe(OH)3+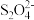 +2OH-=3Fe(OH)2+2 +2OH-=3Fe(OH)2+2 +4H2O +4H2O |
| C.Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热 |
| D.从步骤②中可知OH-和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物 |
您最近一年使用:0次
2021-07-31更新
|
874次组卷
|
5卷引用:黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题
黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题(已下线)2022年新高考化学时事热点情境化考题---镁铝及其化合物天津市第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)秘籍10 金属元素及化合物的相互转化与推断-备战2022年高考化学抢分秘籍(全国通用)(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)
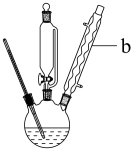
5 . 三颈圆底烧瓶是一种常用的化学玻璃仪器,在有机化学实验中被广泛使用。可以用该仪器来制备苯乙酸铜,以下为实验室合成路线。
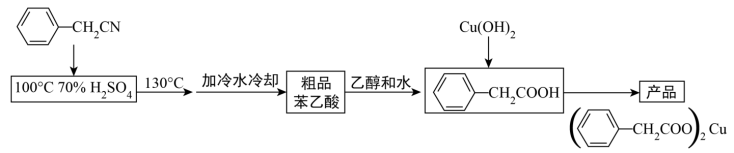
反应的原理为:
 +H2O+H2SO4
+H2O+H2SO4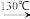
 +NH4HSO4
+NH4HSO4
2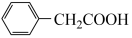 +Cu(OH)2→
+Cu(OH)2→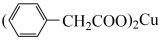 +2 H2O
+2 H2O
(1)在250 mL三颈烧瓶中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是__________________________ 。
(2)仪器b的名称________________ ,其作用是_____________ ;合成苯乙酸时,最合适的加热方法是_____________ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_____________ 。下列仪器中可用于分离苯乙酸粗品的是___________ (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)由于苯乙酸的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是_____ (填字母)。
A. B.
B. C.
C.
(5)在实验中原料用量:5.0 mL苯乙腈,最终称得产品质量为3.2 g,则所得的苯乙酸的产率为_________ %(结果保留三位有效数字)。
(6)将苯乙酸加入到乙醇与水的混合物中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙铜晶体,混合溶剂中乙醇的作用是_________


反应的原理为:
 +H2O+H2SO4
+H2O+H2SO4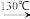
 +NH4HSO4
+NH4HSO42
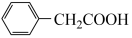 +Cu(OH)2→
+Cu(OH)2→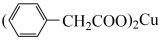 +2 H2O
+2 H2O| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g·cm-3) |
| 苯乙腈 | 117 | -48 | 197 | 微溶于冷水,易溶于乙醇 | 1.08 |
| 苯乙酸 | 136 | 76.5 | 161 | 微溶于冷水,易溶于乙醇 | 1.17 |
(2)仪器b的名称
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)由于苯乙酸的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是
A.
 B.
B. C.
C.
(5)在实验中原料用量:5.0 mL苯乙腈,最终称得产品质量为3.2 g,则所得的苯乙酸的产率为
(6)将苯乙酸加入到乙醇与水的混合物中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2021-07-27更新
|
461次组卷
|
3卷引用:黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
6 . 实验室回收废水中苯酚的过程如图所示。下列分析错误的是


| A.该过程中苯作萃取剂 |
| B.操作Ⅰ、Ⅱ、Ⅲ均涉及分液 |
| C.该过程中苯可循环使用 |
| D.操作Ⅰ、Ⅱ均需要分液漏斗,操作Ⅲ需要漏斗 |
您最近一年使用:0次
2021-06-09更新
|
361次组卷
|
3卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高二下学期期末考试化学试题
解题方法
7 . 为了除去粗盐中的Ca2+、Mg2+、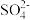 和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是
和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是
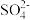 和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是
和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是| A.①④②⑤③ | B.②⑤④③① |
| C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
名校
解题方法
8 . 氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程:
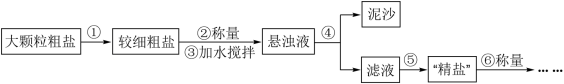
(1)操作①中必须用到的一种仪器是_______ (填字母)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_______ 。
(3)粗盐提纯后的精盐含有氯化钙、氯化镁、硫酸钠等可溶性杂质,常通过加入化学试剂使其转化为沉淀而除去。
a.除去氯化镁加入的试剂是_______ ,反应的化学方程式是_______ 。
b.除去硫酸钠加入的试剂是_______ ,反应的化学方程式是_______ 。
c.在滤液中加盐酸的作用是_______ 、_______ (用离子方程式表示)。

(1)操作①中必须用到的一种仪器是
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是
(3)粗盐提纯后的精盐含有氯化钙、氯化镁、硫酸钠等可溶性杂质,常通过加入化学试剂使其转化为沉淀而除去。
a.除去氯化镁加入的试剂是
b.除去硫酸钠加入的试剂是
c.在滤液中加盐酸的作用是
您最近一年使用:0次
2021-04-12更新
|
177次组卷
|
2卷引用:黑龙江省齐齐哈尔市第八中学2021-2022学年高一下学期6月月考化学试题
名校
9 . 某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是
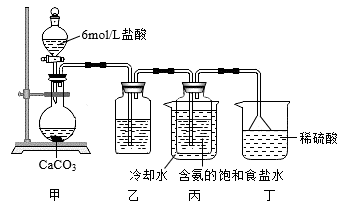

| A.乙装置中盛放的是 NaOH 溶液,以便除去 HCl 气体 |
| B.丙装置中的溶液变浑浊,因为有碳酸氢钠晶体析出 |
| C.丁装置中倒扣的漏斗主要作用是防止污染性空气逸出 |
| D.实验结束后,分离碳酸氢钠的操作是蒸发结晶 |
您最近一年使用:0次
2020-12-23更新
|
535次组卷
|
4卷引用:黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题
黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题广东实验中学2020-2021学年高一上学期期中考试化学试题(已下线)期中测试卷03-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)易错专题14 侯氏制碱法生产纯碱-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
名校
10 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一)KMnO4的制备,分步骤I、II两步进行。
步骤I:先利用如图所示装置制备K2MnO4


(1)装置A应选用______ (填a、b或c)。
(2)装置B中所盛试剂的名称为______ 。
(3)装置C处反应生成K2MnO4的化学方程式为______ 。
步骤II:由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的MnO2;
③再将滤液进行一系列处理,得KMnO4晶体。
(4)过程②向滤液中通入足量CO2,可观察到的现象为______ ;
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录]
(5)为完成实验目的,H2C2O4溶液的物质的量浓度不低于______ 。
(6)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=______ 。
(一)KMnO4的制备,分步骤I、II两步进行。
步骤I:先利用如图所示装置制备K2MnO4


(1)装置A应选用
(2)装置B中所盛试剂的名称为
(3)装置C处反应生成K2MnO4的化学方程式为
步骤II:由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的MnO2;
③再将滤液进行一系列处理,得KMnO4晶体。
(4)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 一定浓度mol·L-1 H2C2O4溶液 | H2O | 0.05 mol·L-1 KMnO4溶液 | 3 mol·L-1稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(6)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=
您最近一年使用:0次



