1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在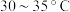 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸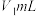 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择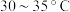 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
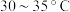 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸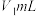 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
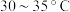 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
7日内更新
|
152次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
2 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: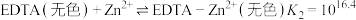
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。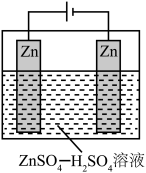

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: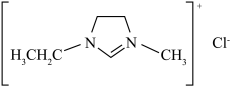

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: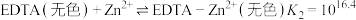
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近一年使用:0次
名校
解题方法
3 . 乙二胺四乙酸铁铵(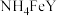 )为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为
)为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为 )、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下:
)、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下: 与
与 在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式
在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式______ 。
(2)探究反应物配比对产品质量的影响
当反应温度、催化剂用量、反应时间都在最佳状态时,反应物配比对产品质量的影响如表1,由表1数据得出,当反应物配比为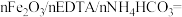
_____ 时,产品铁含量、铵含量及收率达最高,水不溶物含量最低。
表1 反应物配比对产品质量的影响( )
)
(3)反应温度对反应终点的影响如图1,当反应物配比、催化剂一定的条件下,最适宜温度为_______ ,原因:____ 。 )含量的测定,装置如图。
)含量的测定,装置如图。
Ⅱ.称取mg试样,移入圆底烧瓶内,加约300mL蒸馏水,20mL400g/L氢氧化钠溶液,立即连接冷凝装置。
Ⅲ.加热圆底烧瓶内溶液至沸腾,当收集到约150mL馏分时,馏出物明显减少,把锥形瓶稍微移开,使导出管靠在接收器壁上,再加大火力蒸1分钟,移去热源。
IV.向锥形瓶中加入指示剂甲基红-溴甲酚绿乙醇溶液,用浓度为cmol/L的盐酸标准液进行滴定,消耗盐酸标准液的体积为 。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为
。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为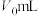 。
。
①所用圆底烧瓶规格为____ mL,A装置的名称为____ 。
②步骤Ⅲ中当馏出物明显减少后,使导出管靠在锥形瓶壁上,再加大火力蒸1分钟的目的是____ 。
③请计算铵( )在试样中的质量分数
)在试样中的质量分数____ 。(用字母列出表达式)
④在滴定过程中会有以下操作,下列哪些操作会使测量值偏大____ (填标号)。
A.未润洗盐酸标准液的酸式滴定管 B.滴定过程中有标准液溅出
C.未润洗锥形瓶 D.滴定完成后俯视读数
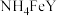 )为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为
)为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为 )、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下:
)、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下: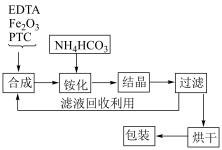
 与
与 在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式
在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式(2)探究反应物配比对产品质量的影响
当反应温度、催化剂用量、反应时间都在最佳状态时,反应物配比对产品质量的影响如表1,由表1数据得出,当反应物配比为
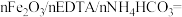
表1 反应物配比对产品质量的影响(
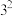 )
)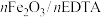 | 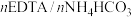 | 铁含量 | 铵含量 | 水不溶物含量 | 收率(%) |
| 0.49:1.0 | 1.0:0.98 | 13.1 | 4.0 | 1.4 | 92.3 |
| 0.49:1.0 | 1.0:1.0 | 13.2 | 4.3 | 0.03 | 91.2 |
| 0.49:1.0 | 1.0:1.02 | 13.2 | 4.4 | 0.03 | 91.6 |
| 0.5:1.0 | 1.0:0.98 | 13.3 | 4.1 | 0.04 | 93.1 |
| 0.5:1.0 | 1.0:1.0 | 13.6 | 4.4 | 0.01 | 96.3 |
| 0.5:1.0 | 1.0:1.02 | 13.5 | 4.4 | 0.05 | 91.7 |
| 0.51:1.0 | 1.0:0.98 | 13.5 | 4.1 | 0.51 | 93.1 |
| 0.51:1.0 | 1.0:1.0 | 13.4 | 4.2 | 0.47 | 93.3 |
| 0.51:1.0 | 1.0:1.02 | 13.4 | 4.2 | 0.54 | 92.1 |
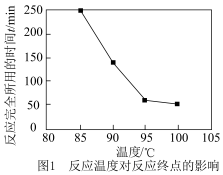
(3)反应温度对反应终点的影响如图1,当反应物配比、催化剂一定的条件下,最适宜温度为
 )含量的测定,装置如图。
)含量的测定,装置如图。
Ⅱ.称取mg试样,移入圆底烧瓶内,加约300mL蒸馏水,20mL400g/L氢氧化钠溶液,立即连接冷凝装置。
Ⅲ.加热圆底烧瓶内溶液至沸腾,当收集到约150mL馏分时,馏出物明显减少,把锥形瓶稍微移开,使导出管靠在接收器壁上,再加大火力蒸1分钟,移去热源。
IV.向锥形瓶中加入指示剂甲基红-溴甲酚绿乙醇溶液,用浓度为cmol/L的盐酸标准液进行滴定,消耗盐酸标准液的体积为
 。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为
。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为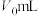 。
。①所用圆底烧瓶规格为
②步骤Ⅲ中当馏出物明显减少后,使导出管靠在锥形瓶壁上,再加大火力蒸1分钟的目的是
③请计算铵(
 )在试样中的质量分数
)在试样中的质量分数④在滴定过程中会有以下操作,下列哪些操作会使测量值偏大
A.未润洗盐酸标准液的酸式滴定管 B.滴定过程中有标准液溅出
C.未润洗锥形瓶 D.滴定完成后俯视读数
您最近一年使用:0次
2024-04-13更新
|
88次组卷
|
2卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
名校
解题方法
4 . 贵州是国内唯一兼具高海拔、低纬度、寡日照、多云雾适宜种茶制茶条件的茶区,是国内业界公认的高品质绿茶重要产地。茶叶中有两种含量最多的功效成分,一是咖啡因,它易溶于水、乙醇、氯仿,二是茶多酚,是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。实验室提取茶多酚主要实验步骤如下:
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入___________ 中,圆底烧瓶内加___________ 和适量乙醇,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是___________ 。
(2)步骤3中氯仿的作用是___________ 。
(3)下列关于萃取过程中振摇操作的示意图,正确的是___________ (填序号)。
A. B.
B.  C.
C.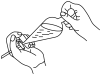
(4)与常压蒸馏相比,减压蒸馏的优点是___________ 。
(5)在酸性介质中,茶多酚能将 还原为
还原为 ,
, 与
与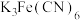 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
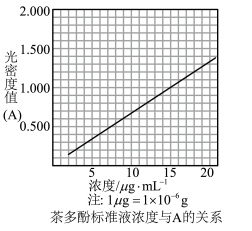
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量 和
和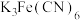 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值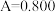 ,则产品的纯度是
,则产品的纯度是___________ (以质量分数表示)。
①准备工作:称取适量干燥的绿茶样品,并将其粉碎成细粉末。
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入
(2)步骤3中氯仿的作用是
(3)下列关于萃取过程中振摇操作的示意图,正确的是
A.
 B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是
(5)在酸性介质中,茶多酚能将
 还原为
还原为 ,
, 与
与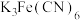 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量
 和
和 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值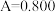 ,则产品的纯度是
,则产品的纯度是
您最近一年使用:0次
解题方法
5 .  加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
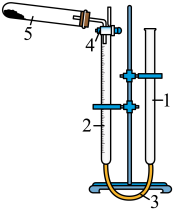
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是____________ (填标号)。
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量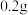 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到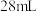 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数________ (写出计算过程)。
 加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量
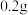 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到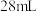 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
6 . Ⅰ. 全钒液流电池 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为 放电工作原理。
放电工作原理。
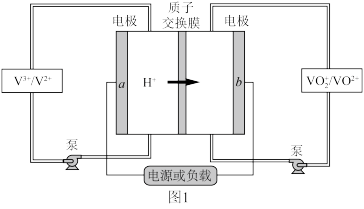
(1)电极 为
为___________ 极(填“正”或“负”),充电时, 电极的反应为
电极的反应为___________ 。
(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
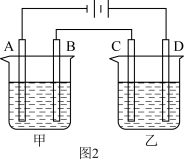
①甲槽是电极电解饱和食盐水的装置,产生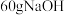 时,
时,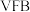 电池中消耗
电池中消耗___________ 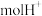 。
。
②乙槽为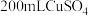 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为___________  。
。
③若通电一段时间后,向所得的乙槽溶液中加入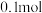 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为___________ (用 表示)。
表示)。
Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有 ,其中
,其中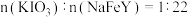 (其中
(其中 显
显 价);
价);
② 。
。
实验步骤:称取 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用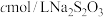 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。
(3)滴定终点的现象为___________ 。
(4)样品中铁元素的质量分数为___________ 。
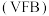 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为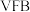 放电工作原理。
放电工作原理。
(1)电极
 为
为 电极的反应为
电极的反应为(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生
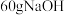 时,
时,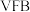 电池中消耗
电池中消耗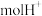 。
。②乙槽为
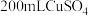 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为 。
。③若通电一段时间后,向所得的乙槽溶液中加入
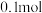 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为 表示)。
表示)。Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有
 ,其中
,其中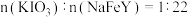 (其中
(其中 显
显 价);
价);②
 。
。实验步骤:称取
 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用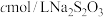 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。(3)滴定终点的现象为
(4)样品中铁元素的质量分数为
您最近一年使用:0次
7 . 维生素C(C6H8O6,M=176)具有重要生理调节功能,在酸性介质中较为稳定,在碱性溶液中易被空气氧化。维生素C通常用I2标准溶液进行滴定,反应原理是:C6H8O6+I2═C6H6O6+2H++2I﹣。回答下列问题:
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在___________ 色试剂瓶中。
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为___________ ,因此配制时往往调溶液至碱性。用Na2S2O3标准溶液标定①中配制的I2标准溶液,计算得I2标准溶液浓度为0.05000mol•L﹣1。
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入___________ 来保存。
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择___________ (填“酸式“或“碱式”)滴定管盛装I2标准溶液。滴定终点的现象是___________ 。
③维C含量的计算
实验过程中测得数据如表:
根据以上数据可得,该药片中维C的质量分数为___________ 。
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
(1)I2标准溶液的配制与标定
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为
(2)维生素C含量的测定
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择
③维C含量的计算
实验过程中测得数据如表:
| 编号 | 1 | 2 | 3 | 4 |
| V(I2标准溶液)/mL | 20.80 | 20.81 | 21.70 | 20.79 |
(3)实际测得药片中维生素C含量比说明书中的含量更高,可能的原因是___________(填标号)。
| A.盛I2标准溶液的酸式滴定管未进行润洗 |
| B.滴定过程中有少量锥形瓶内液体溅出 |
| C.滴定结束时仰视读数 |
| D.用I2标准溶液滴定时操作过慢 |
您最近一年使用:0次
名校
解题方法
8 . 三氯化六氨合钴([Co(NH3)6] Cl3)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:
Ⅰ.制备氯化钴
已知 易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):
易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):___________ 。
(2)装置C中试剂Y为___________ 。
(3)球形干燥管中试剂的作用为___________ 。
Ⅱ.制备三氯化六氨合钴___________ 。
(5)利用CoCl2、NH4Cl、浓氨水、 制备[Co(NH3)6] Cl3的总反应化学方程式为
制备[Co(NH3)6] Cl3的总反应化学方程式为___________ 。
(6)操作 中,加入浓盐酸的作用是
中,加入浓盐酸的作用是___________ 。
Ⅲ.测定钴含量
准确称量3.0000g样品[Co(NH3)6]Cl3,加入 溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将
溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ,用淀粉溶液作指示剂,用0.1000mol/L
,用淀粉溶液作指示剂,用0.1000mol/L 溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积如下(已知:
溶液的体积如下(已知: )。
)。
(7)计算样品中钴元素的质量分数为___________  (保留至小数点后两位)。
(保留至小数点后两位)。
 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:Ⅰ.制备氯化钴
已知
 易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):
易潮解,可用高熔点金属钴与氯气反应制取。实验室提供下图装置进行组合(连接用橡胶管省略):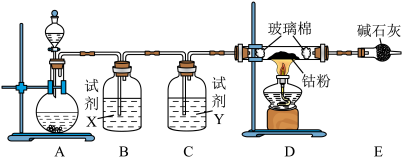
(2)装置C中试剂Y为
(3)球形干燥管中试剂的作用为
Ⅱ.制备三氯化六氨合钴
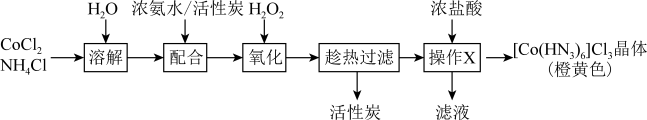
(5)利用CoCl2、NH4Cl、浓氨水、
 制备[Co(NH3)6] Cl3的总反应化学方程式为
制备[Co(NH3)6] Cl3的总反应化学方程式为(6)操作
 中,加入浓盐酸的作用是
中,加入浓盐酸的作用是Ⅲ.测定钴含量
准确称量3.0000g样品[Co(NH3)6]Cl3,加入
 溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将
溶液至样品恰好完全溶解,配成250mL溶液。已知Co3+将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ,用淀粉溶液作指示剂,用0.1000mol/L
,用淀粉溶液作指示剂,用0.1000mol/L 溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积如下(已知:
溶液的体积如下(已知: )。
)。| 滴定次数 | 待测溶液的体积 | 消耗标准溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 11.00 |
| 2 | 25.00 | 11.00 | 21.01 |
| 3 | 25.00 | 21.01 | 31.00 |
(7)计算样品中钴元素的质量分数为
 (保留至小数点后两位)。
(保留至小数点后两位)。
您最近一年使用:0次
2024-01-25更新
|
400次组卷
|
2卷引用:湖北省宜荆荆随恩2023-2024学年高三上学期1月联考化学试题
名校
解题方法
9 . 纯碱在日常生活和工业生产中有着广泛的应用。化工专家侯德榜发明的“侯氏制碱法”为我国纯碱工业和国民经济发展做出了重要贡献。“侯氏制碱法”的反应原理是:
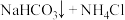 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。

请回答下列问题:
(1)在饱和食盐水中应该由先由_____ 管通_____ 、再由_____ 管通_____ 。
(2)将反应后溶液进行_____ ,得到纯碱样品。
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法_____ 。
(4)为了测定纯碱样品中 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行_____ (“可行”或“不可行”),若可行,请计算出碳酸钠的质量分数_____(保留小数点后一位)。如果不可行,请写出改进方案:_____ 。
(5)如图为NaCl、 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为_____ 。


 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
请回答下列问题:
(1)在饱和食盐水中应该由先由
(2)将反应后溶液进行
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法
(4)为了测定纯碱样品中
 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行(5)如图为NaCl、
 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
您最近一年使用:0次
2024-01-04更新
|
85次组卷
|
2卷引用:河北省石家庄市正定一中、栾城中学、鹿泉区一中等校2023-2024学年高一上学期期中考试化学试题
名校
解题方法
10 . 氧化铁是重要的工业颜料,用废铁屑制备氧化铁的流程如图:
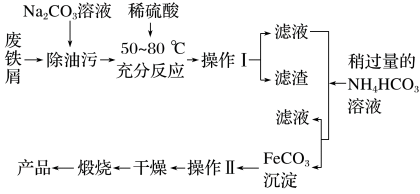
(1)操作Ⅰ的名称是___________ 。
(2)写出废铁屑与稀硫酸反应的离子方程式___________ 。
(3)加入NH4HCO3溶液时,在生成FeCO3沉淀的同时产生了使石灰水变浑浊的气体,写出该反应的离子方程式___________ 。
(4)有些同学认为用酸性KMnO4溶液滴定能进行铁元素含量的测定,其反应如下:5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
+8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
a.称取3.0g绿矾(FeSO4·7H2O)产品,溶解,配制成250 mL一定物质的量浓度的溶液;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.0100 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制100 ml 0.010 00 mol·L-1 KMnO4溶液时,下图不需要的仪器是___________ (写仪器名称)。除这些仪器外,还需要的仪器名称是___________ ;
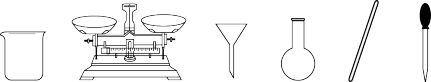
②)配制过程中,下列操作导致溶液浓度偏小的是___________ (填序号)。
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
③计算该样品中铁元素的质量分数___________ 。

(1)操作Ⅰ的名称是
(2)写出废铁屑与稀硫酸反应的离子方程式
(3)加入NH4HCO3溶液时,在生成FeCO3沉淀的同时产生了使石灰水变浑浊的气体,写出该反应的离子方程式
(4)有些同学认为用酸性KMnO4溶液滴定能进行铁元素含量的测定,其反应如下:5Fe2++MnO
 +8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验
+8H+=5Fe3++Mn2++4H2O。为测定某绿矾样品中铁元素含量,进行如下实验a.称取3.0g绿矾(FeSO4·7H2O)产品,溶解,配制成250 mL一定物质的量浓度的溶液;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.0100 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制100 ml 0.010 00 mol·L-1 KMnO4溶液时,下图不需要的仪器是
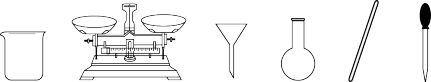
②)配制过程中,下列操作导致溶液浓度偏小的是
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
③计算该样品中铁元素的质量分数
您最近一年使用:0次







