解题方法
1 . 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(主要成分为 ,其中硫元素为
,其中硫元素为 价)在高温条件下和氧气反应制备
价)在高温条件下和氧气反应制备 :
: ,该反应中被氧化的元素是
,该反应中被氧化的元素是______ (填元素符号)。当该反应转移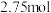 电子时,生成的二氧化硫在标准状况下的体积为
电子时,生成的二氧化硫在标准状况下的体积为______  。
。
(2)实验室中用下列装置测定 被催化氧化为
被催化氧化为 的转化率。(已知
的转化率。(已知 的熔点为
的熔点为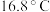 ,假设气体进入装置时均被完全吸收,且忽略空气中
,假设气体进入装置时均被完全吸收,且忽略空气中 的影响)
的影响)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:______ 。
②当停止通入 ,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______ 。
③实验结束后,若装置 增加的质量为mg,装置
增加的质量为mg,装置 中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是
中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______ (用含字母的代数式表示,不用化简)。
(3)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
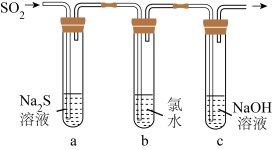
①能说明二氧化硫具有氧化性的实验现象为______ 。
②为验证二氧化硫的还原性,反应一段时间后,取试管 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入 溶液,有白色沉淀生成
溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管 中发生反应的离子方程式为
中发生反应的离子方程式为______ 。
(1)工业上用黄铁矿(主要成分为
 ,其中硫元素为
,其中硫元素为 价)在高温条件下和氧气反应制备
价)在高温条件下和氧气反应制备 :
: ,该反应中被氧化的元素是
,该反应中被氧化的元素是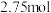 电子时,生成的二氧化硫在标准状况下的体积为
电子时,生成的二氧化硫在标准状况下的体积为 。
。(2)实验室中用下列装置测定
 被催化氧化为
被催化氧化为 的转化率。(已知
的转化率。(已知 的熔点为
的熔点为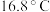 ,假设气体进入装置时均被完全吸收,且忽略空气中
,假设气体进入装置时均被完全吸收,且忽略空气中 的影响)
的影响)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:
②当停止通入
 ,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是③实验结束后,若装置
 增加的质量为mg,装置
增加的质量为mg,装置 中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是
中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是(3)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,反应一段时间后,取试管
 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。方案Ⅰ:向第一份溶液中加入
 溶液,有白色沉淀生成
溶液,有白色沉淀生成方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入
 溶液,产生白色沉淀
溶液,产生白色沉淀上述方案合理的是
 中发生反应的离子方程式为
中发生反应的离子方程式为
您最近一年使用:0次
2020-03-05更新
|
2150次组卷
|
5卷引用:人教版(2019)必修第二册第五章 综合拓展
人教版(2019)必修第二册第五章 综合拓展必修第二册RJ第5章过综合 章末巩固综合检测高一必修第一册(苏教2019版)专题4 B 素养拓展区 过素养 学科素养拓展训练(已下线)练习15 含硫化合物的性质和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)(已下线)课后-5.1.1 硫和二氧化硫-人教2019必修第二册
2 . 花椒油是从花椒籽中提取的一种香精油,具有挥发性,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
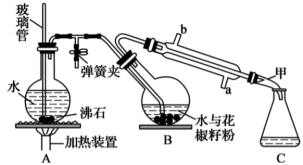
实验步骤:
i.在装置A中的圆底烧瓶中装入 容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
ii.加热装置A中的圆底烧瓶,当有大量水蒸气产生时关闭弹簧夹,进行蒸馏。
iii.向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体注入蒸馏烧瓶,蒸馏得花椒油。
回答下列问题:
(1)装置A中玻璃管的作用是___ ;装置B中圆底烧瓶倾斜的目的是___ 。
(2)步骤ii中,当观察到_____________ 现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为___ (填标号)。
a.停止加热 b.打开弹簧夹 c.关闭冷凝水
(3)在馏出液中加入食盐的作用是___ ;加入无水Na2SO4的作用是___ 。
(4)实验结束后,用稀NaOH溶液清洗冷凝管(冷凝管中的残留物以 表示),反应的化学方程式为
表示),反应的化学方程式为___ 。
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加入92.00mL0.5000mol•L-1NaOH的乙醇溶液,搅拌,充分反应;加水配成200.0mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴酚酞试液,用0.1000mol•L-1HCl溶液进行滴定,滴定终点消耗HCl溶液20.00mL。则该花椒油中含有油脂___ g•L-1(油脂用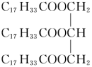 表示,它的相对分子质量为884)。
表示,它的相对分子质量为884)。

实验步骤:
i.在装置A中的圆底烧瓶中装入
 容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加2~3粒沸石。同时在装置B中的圆底烧瓶中加入20g花椒籽粉和50mL水。ii.加热装置A中的圆底烧瓶,当有大量水蒸气产生时关闭弹簧夹,进行蒸馏。
iii.向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体注入蒸馏烧瓶,蒸馏得花椒油。
回答下列问题:
(1)装置A中玻璃管的作用是
(2)步骤ii中,当观察到
a.停止加热 b.打开弹簧夹 c.关闭冷凝水
(3)在馏出液中加入食盐的作用是
(4)实验结束后,用稀NaOH溶液清洗冷凝管(冷凝管中的残留物以
 表示),反应的化学方程式为
表示),反应的化学方程式为(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加入92.00mL0.5000mol•L-1NaOH的乙醇溶液,搅拌,充分反应;加水配成200.0mL溶液,从中取出25.00mL溶液于锥形瓶中,滴入几滴酚酞试液,用0.1000mol•L-1HCl溶液进行滴定,滴定终点消耗HCl溶液20.00mL。则该花椒油中含有油脂
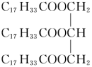 表示,它的相对分子质量为884)。
表示,它的相对分子质量为884)。
您最近一年使用:0次
2021-03-09更新
|
1004次组卷
|
6卷引用:第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)专题6 生命活动的物质基础——糖类、油脂、蛋白质 本专题达标检测广西南宁市2020-2021学年高二上学期期末考试化学试题(已下线)专题七 羧酸 羧酸衍生物-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)3月刊 (同步课堂必刷题)(已下线)3.4 羧酸 羧酸衍生物(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)专题一 油脂-2020-2021学年高二《新题速递·化学》(人教版选修5)4月刊 (同步课堂必刷题)
解题方法
3 . 某学习小组用如图所示装置测定生铁中铁的质量分数。
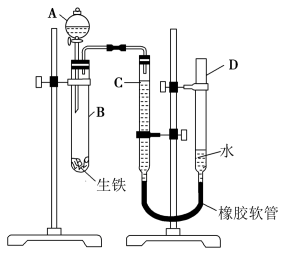
(1)仪器A的名称为__ 。
(2)试管B中发生反应的离子方程式为__ 。
(3)检查装置气密性,将药品(稀硫酸和生铁)和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂。
上述操作的顺序是__ (填标号);记录C的液面位置时,除视线平视外,还应__ 。
(4)若实验所用生铁的质量为ag,测得氢气体积为bmL(已换算为标准状况),则生铁中铁元素的质量分数为__ 。
(5)若将试管B中溶液倒入烧杯,再加入足量的氢氧化钠溶液,可观察到的现象为__ ,用化学方程式解释其原因:__ 。

(1)仪器A的名称为
(2)试管B中发生反应的离子方程式为
(3)检查装置气密性,将药品(稀硫酸和生铁)和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂。
上述操作的顺序是
(4)若实验所用生铁的质量为ag,测得氢气体积为bmL(已换算为标准状况),则生铁中铁元素的质量分数为
(5)若将试管B中溶液倒入烧杯,再加入足量的氢氧化钠溶液,可观察到的现象为
您最近一年使用:0次
名校
4 . 为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
已知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
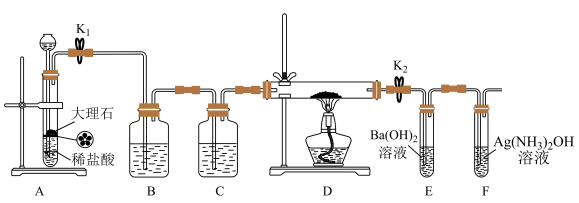
回答下列问题:
(1)B中的溶液为______________ 。
(2)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是____________ (填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________ ;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3;假设二:只有Na2O;假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________ 。
已知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)B中的溶液为
(2)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3;假设二:只有Na2O;假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
| 步骤 | 操作和现象 | 结论 |
| 1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
| 2 | 往步骤1所得滤液中 现象: |
| m1 | m2 | m3 |
| 66.7g | 69.0g | 72.1g |
您最近一年使用:0次
2020-01-17更新
|
1521次组卷
|
6卷引用:人教版(2019)高一必修第一册 第二章素养检测
5 . 乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
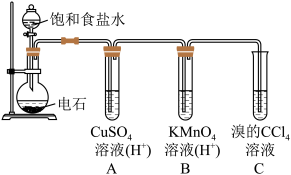
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________ ,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________ (用百分数表示)

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式
(2)用饱和食盐水代替蒸馏水的目的是
(3)装置A的作用是
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为
您最近一年使用:0次
2019-11-11更新
|
405次组卷
|
2卷引用:人教版高中化学(2019)必修第二册第七章《有机化合物》检测题
名校
6 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是________ 。
②将下列实验操作步骤正确排序_______ (填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2 c.关闭K1和K2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______ (列式表示)。若实验时按a、b次序操作,则使x_______ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
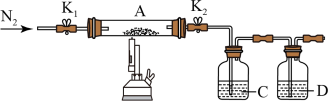
①C中的溶液为BaCl2,其作用是______ 。D溶液为______ ,D中可观察到的现象为_______ 。
②写出硫酸亚铁高温分解反应的化学方程式________ 。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施____ 。
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2 c.关闭K1和K2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C中的溶液为BaCl2,其作用是
②写出硫酸亚铁高温分解反应的化学方程式
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施
您最近一年使用:0次
2019-10-29更新
|
325次组卷
|
4卷引用:第三章 章末检测(2)——《高中新教材同步备课》(人教版 必修第一册)
(已下线)第三章 章末检测(2)——《高中新教材同步备课》(人教版 必修第一册)湖北省荆、荆、襄、宜四地七校(襄阳五中,襄阳四中等)2020届高三10月联考化学试题河北省大名县第一中学2020届高三11月月考(重点班)化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题
7 . 已知SO2+I2+2H2O=H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
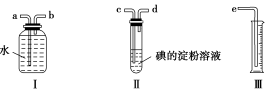
(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________ (填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________ ;当装置Ⅱ中出现________ 现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________ 。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→
(2)装置Ⅱ中发生反应的离子方程式为
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为
您最近一年使用:0次
2018-09-06更新
|
466次组卷
|
6卷引用:2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)
8 . FeCl3在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备FeCl3。已知:FeCl3加热易升华,在空气中易潮解。
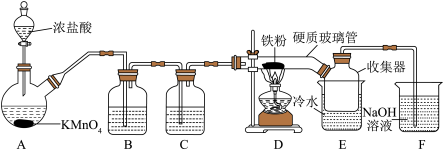
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ ;该反应体现了浓盐酸的性质是_______ 。
(2)装置C的作用是_______ ;硬质玻璃管直接接入收集器而不用导管连接D和E的原因是_______ 。
(3)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是_______ 。
(4)装置F中发生反应的离子方程式为_______ 。
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知: )。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
)。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为_______ 。

回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置C的作用是
(3)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是
(4)装置F中发生反应的离子方程式为
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知:
 )。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
)。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
您最近一年使用:0次
2022-11-19更新
|
329次组卷
|
4卷引用:章末检测卷(二) 元素与物质世界
9 . 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________ 。
【探究二】
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________ 。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):

(3)装置B中试剂的作用是________ 。
(4)认为气体Y中还含有Q的理由是_____________________ (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________ (选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________ 。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
【探究二】
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):

(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是
(5)为确认Q的存在,需在装置中添加M于
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是
您最近一年使用:0次
2016-12-09更新
|
637次组卷
|
4卷引用:山西省忻州市第一中学高一化学下学期(远程)目标检测(4)化学试题
11-12高三上·全国·单元测试
10 . 有人设计一个Na2O2与CO2反应实验装置图如下:

打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:_________________________________
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。

请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________ 、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①③②进行实验,他测得的数据是_____________ 。按他测得的数据计算出的实验结果偏高,理由是_____________________ 。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序___________________________ 。
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1g和w2g,则样品中碳酸钠的质量分数为_______________________ 。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处______ (若没有,此空不必回答;若有,请一并说出不足的理由)_________________ 。

打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。

请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、
②乙同学通过连接仪器①③②进行实验,他测得的数据是
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1g和w2g,则样品中碳酸钠的质量分数为
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处
您最近一年使用:0次



