解题方法
1 . Ⅰ.研究铁的腐蚀,实验步骤如下:
步骤1:将铁粉放置于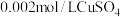 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向 溶液(用盐酸调至
溶液(用盐酸调至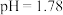 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。_______ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为_______ 。
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是_______ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
①镀件Fe应与电源的_______ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是_______ 。
(4)电镀后的废水中含有 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液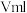 。
。
已知 (无色)
(无色) 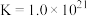
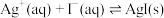 (黄色)
(黄色) 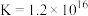
①滴定终点的现象是______________ 。
②废水中 的含量是
的含量是_______ g/L(用含C、V的代数式表示)。
步骤1:将铁粉放置于
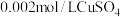 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向
 溶液(用盐酸调至
溶液(用盐酸调至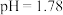 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。
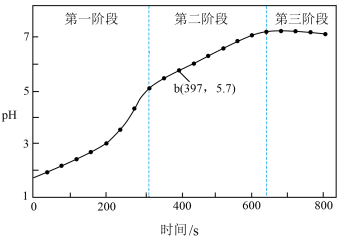
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液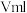 。
。已知
 (无色)
(无色) 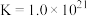
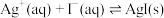 (黄色)
(黄色) 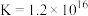
①滴定终点的现象是
②废水中
 的含量是
的含量是
您最近一年使用:0次
名校
2 . 锶(Sr)和镁位于同主族,锶比镁更活泼,锶与氮气在加热条件下反应产生氮化锶,已知氮化锶遇水剧烈反应。某同学设计如下两种不同装置制备氮化锶(Sr3N2式量:290.8)。

方案I:上图1是用饱和氯化铵溶液和亚硝酸钠溶液制备氮气来制取氮化锶。
(1)仪器A的名称是___________ 。
(2)实验时先点燃___________ 处酒精灯(填“B”或“C”),一段时间后,再点燃另一只酒精灯。
方案II:上图2是直接利用氮气样品来制取氮化锶。
已知:①所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力,连苯三酚碱性溶液能定量吸收O2。
(3)装置F、G、H盛装的试剂分别是___________ (填代号)。
a.浓硫酸 b.连苯三酚碱性溶液 c.醋酸二氨合亚铜溶液
(4)方案I和方案II装置设计存在相同的缺陷,可能会导致产品变质,提出改进措施为:_____ 。
(5)产品纯度的测定:称取0.8000g方案I中所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用20.00mL1.00mol/L的盐酸标准溶液完全吸收,再用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。
①若用酚酞作指示剂,滴定终点的现象是___________ ;
②则产品纯度为___________ (计算结果保留4位有效数字);
③若氨没有完全蒸出,则会导致产品纯度___________ (填“偏大”、“偏小”或“不影响”)。

方案I:上图1是用饱和氯化铵溶液和亚硝酸钠溶液制备氮气来制取氮化锶。
(1)仪器A的名称是
(2)实验时先点燃
方案II:上图2是直接利用氮气样品来制取氮化锶。
已知:①所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力,连苯三酚碱性溶液能定量吸收O2。
(3)装置F、G、H盛装的试剂分别是
a.浓硫酸 b.连苯三酚碱性溶液 c.醋酸二氨合亚铜溶液
(4)方案I和方案II装置设计存在相同的缺陷,可能会导致产品变质,提出改进措施为:
(5)产品纯度的测定:称取0.8000g方案I中所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用20.00mL1.00mol/L的盐酸标准溶液完全吸收,再用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。
①若用酚酞作指示剂,滴定终点的现象是
②则产品纯度为
③若氨没有完全蒸出,则会导致产品纯度
您最近一年使用:0次
3 . 测定“84”消毒液中次氯酸钠的浓度可用下面方法:取10.00 mL消毒液,调节pH后,以淀粉为指示剂,用0.100mol·L-1 KI溶液进行滴定,当溶液出现稳定浅蓝色时为滴定终点。反应原理为:3ClO-+I-=3Cl-+IO ;IO
;IO +5I-+6H+=3H2O+3I2;三次平行实验中消耗KI的平均体积为20.00mL,由此可知原消毒液中NaClO的物质的量浓度为
+5I-+6H+=3H2O+3I2;三次平行实验中消耗KI的平均体积为20.00mL,由此可知原消毒液中NaClO的物质的量浓度为
 ;IO
;IO +5I-+6H+=3H2O+3I2;三次平行实验中消耗KI的平均体积为20.00mL,由此可知原消毒液中NaClO的物质的量浓度为
+5I-+6H+=3H2O+3I2;三次平行实验中消耗KI的平均体积为20.00mL,由此可知原消毒液中NaClO的物质的量浓度为| A.0.04mol·L-1 | B.0.10mol·L-1 | C.0.25mol·L-1 | D.0.60mol·L-1 |
您最近一年使用:0次
解题方法
4 . 二氧化硫及硫酸盐在生活、生产中有重要应用。回答下列问题:
I.测定晶体结晶水含量的实验中常选择胆矾作为实验对象进行研究。
(1)结合已有知识及表格中信息解释原因_______ 。
II.《唐本草》和《天工开物》等古籍均记载中国很早就焙烧绿矾制备铁红(主要成分Fe2O3,是一种传统颜料的着色剂)和含硫气体等。
(2)对含硫气体的成分,某学生做出三种假设:①含硫气体为SO2;②含硫气体为SO3;③含硫气体为SO2和SO3。从上述三种假设中挑选一种不合理的,做出解释:_______ 。
(3)将盛有绿矾的硬质玻璃管A按下图装置,加强热使其充分反应。
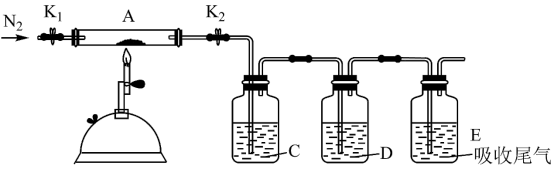
C、D中的溶液依次为_______ 、_______ (选填字母编号)。
a.品红溶液 b.Ba(OH)2溶液 c.盐酸酸化的BaCl2溶液 d.浓硫酸
III.SO2常用于食品加工中作防腐剂、漂白剂。我国规定葡萄酒中SO2最大使用量为0.26g·L-1。某研究小组测定葡萄酒中SO2含量的方法为:在300.00mL葡萄酒中加入适量稀硫酸,加热使SO2全部逸出,并用H2O2完全吸收,再将吸收了SO2的H2O2充分加热后,用0.0900mol·L-1NaOH溶液进行滴定。
(4)H2O2吸收SO2的化学方程式为_______ 。“将吸收了SO2的H2O2充分加热”目的是_______ 。
(5)若选用酚酞作指示剂,滴定终点的现象为_______ 。滴定终点时消耗NaOH溶液25.00mL,该葡萄酒中的SO2含量为_______ g·L-1。该葡萄酒的此项指标被判定为_______ 。(选填:合格、不合格)
I.测定晶体结晶水含量的实验中常选择胆矾作为实验对象进行研究。
(1)结合已有知识及表格中信息解释原因
| 明矾 | 胆矾 | 绿矾 | |
| 化学式 | KAl(SO4)2·12H2O | CuSO4·5H2O | FeSO4·7H2O |
| 色态 | 无色透明 | 蓝色 | 浅绿色 |
| 失去全部结晶水温度(℃) | 200 | 200 | 300 |
II.《唐本草》和《天工开物》等古籍均记载中国很早就焙烧绿矾制备铁红(主要成分Fe2O3,是一种传统颜料的着色剂)和含硫气体等。
(2)对含硫气体的成分,某学生做出三种假设:①含硫气体为SO2;②含硫气体为SO3;③含硫气体为SO2和SO3。从上述三种假设中挑选一种不合理的,做出解释:
(3)将盛有绿矾的硬质玻璃管A按下图装置,加强热使其充分反应。

C、D中的溶液依次为
a.品红溶液 b.Ba(OH)2溶液 c.盐酸酸化的BaCl2溶液 d.浓硫酸
III.SO2常用于食品加工中作防腐剂、漂白剂。我国规定葡萄酒中SO2最大使用量为0.26g·L-1。某研究小组测定葡萄酒中SO2含量的方法为:在300.00mL葡萄酒中加入适量稀硫酸,加热使SO2全部逸出,并用H2O2完全吸收,再将吸收了SO2的H2O2充分加热后,用0.0900mol·L-1NaOH溶液进行滴定。
(4)H2O2吸收SO2的化学方程式为
(5)若选用酚酞作指示剂,滴定终点的现象为
您最近一年使用:0次
解题方法
5 . 测定a g小苏打(含少量氯化钠)中NaHCO3含量,下列说法错误的是
| 测定方法 | 选用试剂 | 测量数据 | |
| A | 重量法 | 稀硝酸、硝酸银 | m(AgCl) |
| B | 气体法 | 稀硫酸 | V(CO2) |
| C | 滴定法 | 甲基橙、稀盐酸 | V(HCl) |
| D | 重量法 | 氢氧化钡 | m(BaCO3) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO 和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。

检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
(1)装置Ⅰ中反应的化学方程式为_______ ,若取消装置Ⅱ,对本实验的影响是_______ 。
(2)从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和_______ 。对粗产品提纯采用采用何种结晶法,需要查得KClO3的溶解度受温度影响的数据,是否需要查得杂质KClO的该项数据_______ (选填“是”或“否”),理由是:_______ 。
(3)已知碱性条件下,ClO-有强氧化性,而ClO 氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO
氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO 氧化
氧化_______ 。
(4)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO +6I-+6H+=Cl-+3I2+3H2O)
+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
①样品中KClO3的质量分数为_______ ;
②步骤2的目的是_______ ;若没有“煮沸”操作,测定结果_______ (选填偏大、偏小或无影响)。
 和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。
检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
(1)装置Ⅰ中反应的化学方程式为
(2)从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和
(3)已知碱性条件下,ClO-有强氧化性,而ClO
 氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO
氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO 氧化
氧化(4)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO
 +6I-+6H+=Cl-+3I2+3H2O)
+6I-+6H+=Cl-+3I2+3H2O)步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O
 +I2=S4O
+I2=S4O +2I-)
+2I-)①样品中KClO3的质量分数为
②步骤2的目的是
您最近一年使用:0次
名校
7 . 摩尔盐[(NH4)2Fe(SO4)2·6H2O,M=392g/mol]可按以下流程制得二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度的还原铁粉:

已知:FeC2O4·2H2O难溶于水:H2C2O4易溶于水,溶解度随温度的升高而增大。完成下列填空:
(1)步骤②中,H2C2O4稍过量的原因是_______
(2)为提高FeC2O4·2H2O的纯度,步骤③中宜用_______ (选填“热水”、“冷水”或“无水酒精”)洗涤
(3)实验室为实现步骤④必须用到下列仪器中的_______ (选填编号)
a.烧杯 b.坩埚 c.锥形瓶 d.玻璃棒 e.石棉网
(4)写出步骤⑤不宜用炭粉还原Fe2O3的理由_______
(5)称取某摩尔盐样品14.00g,用煮沸后冷却的蒸馏水配成100mL溶液;取20.00mL溶液加入稀硫酸,用0.1000mol/L的KMnO4溶液滴定,发生反应:5Fe2++ +8H+→5Fe3++Mn2++4H2O。
+8H+→5Fe3++Mn2++4H2O。
①达到滴定终点时,消耗10.00mLKMnO4溶液滴定终点的现象是_______ ,该摩尔盐的纯度是_______ 。
②实验结果比理论值偏低的可能原因是_______ (选填编号)
a.滴定管洗净后直接加入KMnO4溶液
b.滴定过程有少量样品溶液溅出
c.滴定前仰视滴定管读数
d.滴定后滴定管尖嘴处气泡消失

已知:FeC2O4·2H2O难溶于水:H2C2O4易溶于水,溶解度随温度的升高而增大。完成下列填空:
(1)步骤②中,H2C2O4稍过量的原因是
(2)为提高FeC2O4·2H2O的纯度,步骤③中宜用
(3)实验室为实现步骤④必须用到下列仪器中的
a.烧杯 b.坩埚 c.锥形瓶 d.玻璃棒 e.石棉网
(4)写出步骤⑤不宜用炭粉还原Fe2O3的理由
(5)称取某摩尔盐样品14.00g,用煮沸后冷却的蒸馏水配成100mL溶液;取20.00mL溶液加入稀硫酸,用0.1000mol/L的KMnO4溶液滴定,发生反应:5Fe2++
 +8H+→5Fe3++Mn2++4H2O。
+8H+→5Fe3++Mn2++4H2O。①达到滴定终点时,消耗10.00mLKMnO4溶液滴定终点的现象是
②实验结果比理论值偏低的可能原因是
a.滴定管洗净后直接加入KMnO4溶液
b.滴定过程有少量样品溶液溅出
c.滴定前仰视滴定管读数
d.滴定后滴定管尖嘴处气泡消失
您最近一年使用:0次
名校
解题方法
8 . 利用图中实验装置进行的相应实验,能达到实验目的的是
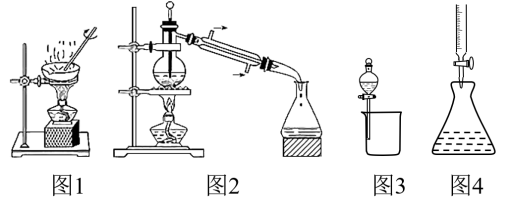

| A.利用图1装置可从胆矾晶体中获得无水硫酸铜 |
| B.利用图2装置可分离石油,得到汽油、煤油和柴油等各种馏分 |
| C.利用图3装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| D.利用图4装置可进行酸碱中和滴定 |
您最近一年使用:0次
2020-12-31更新
|
437次组卷
|
4卷引用:上海市奉贤区2021届高三一模化学试卷
上海市奉贤区2021届高三一模化学试卷(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)上海市市西中学2021-2022学年高三下学期 4月月考(期中)化学试题广西桂林市第十八中学2021届高三上学期第八次月考理科综合化学试题
9 . 摩尔盐[(NH4)2Fe(SO4)2•6H2O,M=392 g/mol]可按以下流程制得二水合草酸亚铁(FeC2O4•2H2O),进一步制备高纯度的还原铁粉:

已知:FeC2O4•2H2O难溶于水;H2C2O4易溶于水,溶解度随温度的升高而增大。
完成下列填空:
(1)摩尔盐溶解后,溶液中的离子浓度由大到小的顺序是___________ 。
(2)步骤②中,H2C2O4稍过量的原因是___________ 。
(3)为提高FeC2O4•2H2O的纯度,步骤③中宜用___________ (选填“热水”、“冷水”或“无水酒精”)洗涤。
(4)实验室为实现步骤④必须要用到下列仪器中的___________ 。(选填编号)
a.烧杯 b.坩埚 c.锥形瓶 d.玻璃棒 e.石棉网
(5)写出步骤⑤不宜用炭粉还原Fe2O3的理由___________
(6)称取某摩尔盐样品14.00g,用煮沸后冷却的蒸馏水配成100mL溶液;取20.00mL溶液加入稀硫酸,用0.1000mol/L的KMnO4溶液滴定,发生反应:5Fe2++MnO +8H+→5Fe3++Mn2++4H2O达到滴定终点时消耗10.00 mL KMnO4溶液。滴定终点的现象是
+8H+→5Fe3++Mn2++4H2O达到滴定终点时消耗10.00 mL KMnO4溶液。滴定终点的现象是___________ ,该摩尔盐的纯度是___________ 。实验结果比理论值偏低的可能原因是___________ 。(选填编号)
a.滴定管洗净后直接加入KMnO4溶液
b.滴定过程有少量样品溶液溅出
c.滴定前仰视滴定管读数
d.滴定后滴定管尖嘴处气泡消失

已知:FeC2O4•2H2O难溶于水;H2C2O4易溶于水,溶解度随温度的升高而增大。
完成下列填空:
(1)摩尔盐溶解后,溶液中的离子浓度由大到小的顺序是
(2)步骤②中,H2C2O4稍过量的原因是
(3)为提高FeC2O4•2H2O的纯度,步骤③中宜用
(4)实验室为实现步骤④必须要用到下列仪器中的
a.烧杯 b.坩埚 c.锥形瓶 d.玻璃棒 e.石棉网
(5)写出步骤⑤不宜用炭粉还原Fe2O3的理由
(6)称取某摩尔盐样品14.00g,用煮沸后冷却的蒸馏水配成100mL溶液;取20.00mL溶液加入稀硫酸,用0.1000mol/L的KMnO4溶液滴定,发生反应:5Fe2++MnO
 +8H+→5Fe3++Mn2++4H2O达到滴定终点时消耗10.00 mL KMnO4溶液。滴定终点的现象是
+8H+→5Fe3++Mn2++4H2O达到滴定终点时消耗10.00 mL KMnO4溶液。滴定终点的现象是a.滴定管洗净后直接加入KMnO4溶液
b.滴定过程有少量样品溶液溅出
c.滴定前仰视滴定管读数
d.滴定后滴定管尖嘴处气泡消失
您最近一年使用:0次
名校
解题方法
10 . 有一Na2SO3固体样品因保存时间较长,部分被氧化而变质了。
(1)Na2SO3溶液呈________ 性(选填“酸”、“碱”、“中”),在Na2SO3溶液中加少量________ 可以使[Na+]与[ ]比值接近2:1。
]比值接近2:1。
(2)在0.1mol/L的Na2SO3溶液中,下列关系式正确的有___________ 。
a.[Na+]>[ ]>[
]>[ ]>[OH-]>[H+] b.[Na+]+[H+]=[
]>[OH-]>[H+] b.[Na+]+[H+]=[ ]+[
]+[ ]+[OH-]
]+[OH-]
c.[Na+]= [ ]+[
]+[ ]+[H2SO3] d.[H+]+[
]+[H2SO3] d.[H+]+[ ]=[
]=[ ]+[OH-]
]+[OH-]
(3)Na2SO3在空气中变质的原因是________ (用化学方程式表示)。
为测定样品纯度,甲、乙两位同学分别分别进行了设计和思考:
【甲同学】:称取m g样品溶于水,加入过量稀盐酸,再加入过量的BaCl2溶液。过滤,将滤渣洗涤后进行烘干,冷却后称得质量为n g。
(4)BaCl2溶液必须过量的原因是_______ 。检验BaCl2溶液足量的方法是______ 。
(5)甲同学实验测得亚硫酸钠的纯度是______ 。
【乙同学】:称取a g样品溶于250mL水中,并取出25mL,用浓度为b mol/L的酸性高锰酸钾溶液滴定至终点,消耗酸性高锰酸钾溶液V mL。
(6)滴定终点的现象是______ 。
(7)乙同学实验测得亚硫酸钠的纯度是______ 。
(1)Na2SO3溶液呈
 ]比值接近2:1。
]比值接近2:1。(2)在0.1mol/L的Na2SO3溶液中,下列关系式正确的有
a.[Na+]>[
 ]>[
]>[ ]>[OH-]>[H+] b.[Na+]+[H+]=[
]>[OH-]>[H+] b.[Na+]+[H+]=[ ]+[
]+[ ]+[OH-]
]+[OH-]c.[Na+]= [
 ]+[
]+[ ]+[H2SO3] d.[H+]+[
]+[H2SO3] d.[H+]+[ ]=[
]=[ ]+[OH-]
]+[OH-](3)Na2SO3在空气中变质的原因是
为测定样品纯度,甲、乙两位同学分别分别进行了设计和思考:
【甲同学】:称取m g样品溶于水,加入过量稀盐酸,再加入过量的BaCl2溶液。过滤,将滤渣洗涤后进行烘干,冷却后称得质量为n g。
(4)BaCl2溶液必须过量的原因是
(5)甲同学实验测得亚硫酸钠的纯度是
【乙同学】:称取a g样品溶于250mL水中,并取出25mL,用浓度为b mol/L的酸性高锰酸钾溶液滴定至终点,消耗酸性高锰酸钾溶液V mL。
(6)滴定终点的现象是
(7)乙同学实验测得亚硫酸钠的纯度是
您最近一年使用:0次



