1 . 磺酰胺[SO2(NH2)2]易溶于醇,溶于热水,不溶于冷水,在酸性、中性、碱性水溶液中性质稳定,主要用于制造医药、农药、染料等。制备磺酰胺的装置如下,其原理为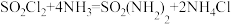 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
Ⅰ.磺酰胺的制备____________ 。
(2)装置B中盛放的试剂为____________ (填字母)。
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:____________ 。
(4)装置C中多孔球泡的作用是____________ 。
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)____________ ,单向阀的作用是____________ 。
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是____________ (列出计算式)。
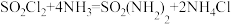 。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。
。已知:磺酰氯(SO2Cl2)熔点为-54.1℃,沸点为69.1℃,遇潮湿空气会水解产生酸雾。Ⅰ.磺酰胺的制备

(2)装置B中盛放的试剂为
a.碱石灰 b.浓硫酸 c.P2O5 d.无水CaCl2
(3)写出 SO2Cl2水解的化学方程式:
(4)装置C中多孔球泡的作用是
Ⅱ.用如下装置测定产品SO2(NH2)2的含量(假设只含NH4Cl杂质,部分装置已省略)
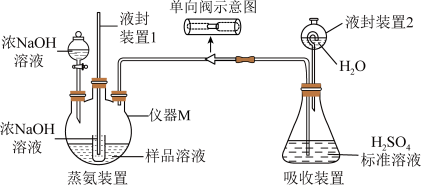
(6)滴定:将液封装置2中的水放入锥形瓶中,再将锥形瓶中的溶液倒入容量瓶中配制成500 mL的溶液,取20 mL溶液用c2 mol/L的NaOH标准溶液滴定过量的H2SO4,共消耗NaOH标准溶液V2 mL,产品中SO2(NH2)2的含量是
您最近一年使用:0次
2024-03-21更新
|
605次组卷
|
6卷引用:2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学
2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学黑龙江省部分学校2024届高三第二次模拟考试化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题湖北省黄冈中学2024届高三下学期5月第二次模拟考试化学试卷黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(一)
2 . 二氧化硒(SeO2)是一种白色晶体,315℃升华,易潮解生成亚硒酸(弱酸),广泛应用于制药、化工、冶金及农业等领域。由粗硒(主要含Se和Au、Ag、Cu、Pb等金属单质)制备二氧化硒的工艺流程如下:

回答下列问题:
(1)氧化时反应温度高于315℃,主要目的之一是有利于反应生成二氧化硒,之二是___________ 。
(2)HNO3是氧气与硒反应的催化剂。氧化前反应物必须干燥,否则硝酸会与硒发生反应生成亚硒酸和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)若将氧化后的残渣用足量稀硝酸浸取,浸渣的主要成分是___________ ;欲将该浸渣的主要成分溶解,可选用下列试剂中的___________ (填标号)。
A.浓烧碱 B.浓盐酸 C.浓硝酸 D.王水
(4)排出气的主要成分有氧气和少量氮氧化物、HNO3、SeO2,水吸收时难溶于水的NO和部分O2也能被吸收,原因是___________ (用化学方程式表示);水吸收所得溶液中含有亚硒酸,通入SO2将其还原,反应的离子方程式为___________ 。
(5)产品中SeO2的含量可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3=Na2S4O6+2NaI
方程式①中还原剂和氧化剂的物质的量之比为___________ ;利用方程式②滴定时,指示剂为___________ ;准确称量SeO2样品0.1200g,消耗了0.2000mol/L的Na2S2O3溶液20.00mL测得产品中SeO2的质量分数为___________ 。

回答下列问题:
(1)氧化时反应温度高于315℃,主要目的之一是有利于反应生成二氧化硒,之二是
(2)HNO3是氧气与硒反应的催化剂。氧化前反应物必须干燥,否则硝酸会与硒发生反应生成亚硒酸和
 ,该反应的化学方程式为
,该反应的化学方程式为(3)若将氧化后的残渣用足量稀硝酸浸取,浸渣的主要成分是
A.浓烧碱 B.浓盐酸 C.浓硝酸 D.王水
(4)排出气的主要成分有氧气和少量氮氧化物、HNO3、SeO2,水吸收时难溶于水的NO和部分O2也能被吸收,原因是
(5)产品中SeO2的含量可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)
②I2+2Na2S2O3=Na2S4O6+2NaI
方程式①中还原剂和氧化剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将准确称量的0.20 g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃ 左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用___________ 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为_________ 。
(3)在步骤②中,下列操作会引起测定结果偏高的是___________ 。
A、滴定管在盛装高锰酸钾前未润洗 B、滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数 D、滴定前读数正确,滴定终点时仰视读数
(4)0.20 g样品中FeC2O4的质量分数为___________ 。(不考虑步骤②中的损耗)
①将准确称量的0.20 g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃ 左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为
(3)在步骤②中,下列操作会引起测定结果偏高的是
A、滴定管在盛装高锰酸钾前未润洗 B、滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数 D、滴定前读数正确,滴定终点时仰视读数
(4)0.20 g样品中FeC2O4的质量分数为
您最近一年使用:0次
2021-04-22更新
|
92次组卷
|
2卷引用:云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题
4 . ClO2是一种强氧化剂,被广泛用于对水的净化和纸张、纤维、纺织品的漂白。ClO2在室温下是黄绿色气体,极易溶于水,冷凝时为红色液体,熔点214K,沸点283K。实验室用如图甲所示装置A制备ClO2。
已知:①ClO2在受热(358K以上)或浓度过高时均易爆炸,因此常将其制成NaClO2固体,便于运输和贮存。
②NaClO2饱和溶液随温度变化情况如图乙:


回答下列问题:
(1)盛放浓硫酸的仪器名称是__________ ,实验过程中需持续通入空气,其目的是________ 。
(2)要制备6.72LClO2(标况下)理论上需要Na2SO3的质量是_________________ 。
(3)装置C中生成NaClO2的离子方程式为____________________________ 。
(4)从图甲装置C反应后的溶液中获得NaClO2晶体的操作步骤为:①在55℃蒸发结晶;②________ ;③用38~60℃热水洗涤;④______
(5)利用碘量法测定自来水中ClO2的残留量,测定步骤如下:
Ⅰ.在锥形瓶中用50mL蒸馏水溶解足量的KI,再加入少量稀硫酸
Ⅱ.将20.00mL自来水加入锥形瓶中
Ⅲ.以淀粉作指示剂,用0.100mol/LNa2S2O3标准溶液滴定(I2+2 =2I-+
=2I-+ )
)
①达到滴定终点的现象为_____________________________________________ 。
②平行滴定3次,标准液的平均用量为bmL,则水样中ClO2含量为_____ mg/L。
已知:①ClO2在受热(358K以上)或浓度过高时均易爆炸,因此常将其制成NaClO2固体,便于运输和贮存。
②NaClO2饱和溶液随温度变化情况如图乙:


回答下列问题:
(1)盛放浓硫酸的仪器名称是
(2)要制备6.72LClO2(标况下)理论上需要Na2SO3的质量是
(3)装置C中生成NaClO2的离子方程式为
(4)从图甲装置C反应后的溶液中获得NaClO2晶体的操作步骤为:①在55℃蒸发结晶;②
(5)利用碘量法测定自来水中ClO2的残留量,测定步骤如下:
Ⅰ.在锥形瓶中用50mL蒸馏水溶解足量的KI,再加入少量稀硫酸
Ⅱ.将20.00mL自来水加入锥形瓶中
Ⅲ.以淀粉作指示剂,用0.100mol/LNa2S2O3标准溶液滴定(I2+2
 =2I-+
=2I-+ )
)①达到滴定终点的现象为
②平行滴定3次,标准液的平均用量为bmL,则水样中ClO2含量为
您最近一年使用:0次
名校
5 . 甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(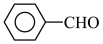 )、苯甲酸(
)、苯甲酸(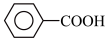 )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈烧瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
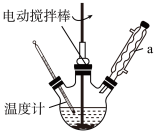
(1)仪器a的名称是___ ,写出三颈烧瓶中发生的反应的化学方程式为___ 。
(2)经测定,温度过高时,苯甲醛的产量却有所减少,可能的原因是___ 。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应先过滤,然后将滤液进行___ (填操作名称)操作,才能得到苯甲醛产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是:首先与适量碳酸氢钠溶液混合振荡,后续实验步骤先后顺序为___ (用字母填写)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取4.00g产品,溶于乙醇配成200mL溶液,量取所得溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/LKOH标准液滴定,到达滴定终点时消耗KOH溶液20.00mL。产品中苯甲酸的质量分数为___ 。下列情况会使测定结果偏低的是__ (填字母)。
a.碱式滴定管滴定前读数正确,滴定终了仰视读取数据
b.振荡锥形瓶时部分液体溅出
c.配制KOH标准液时仰视定容
d.将指示剂换为甲基橙溶液
 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ=1g/cm3) | 溶解性(常温) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈烧瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)仪器a的名称是
(2)经测定,温度过高时,苯甲醛的产量却有所减少,可能的原因是
(3)反应完毕,反应混合液经过自然冷却至室温后,还应先过滤,然后将滤液进行
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是:首先与适量碳酸氢钠溶液混合振荡,后续实验步骤先后顺序为
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取4.00g产品,溶于乙醇配成200mL溶液,量取所得溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/LKOH标准液滴定,到达滴定终点时消耗KOH溶液20.00mL。产品中苯甲酸的质量分数为
a.碱式滴定管滴定前读数正确,滴定终了仰视读取数据
b.振荡锥形瓶时部分液体溅出
c.配制KOH标准液时仰视定容
d.将指示剂换为甲基橙溶液
您最近一年使用:0次
名校
6 . 三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷。可用如图流程来制备:

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O,______ (填物质名称)往往要过量,理由是______ 。
(2)要从溶液中得到绿矾,必须进行的实验操作是_______ 。(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时MnO 被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO ,被还原成Mn2+。
,被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
回答下列小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有______ ;主要操作步骤依次是:称量、溶解、转移、______ 、定容、摇匀。
(4)加入锌粉的目的是________ 。
(5)实验测得该晶体中铁的质量分数为____ 。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量______ 。(选填“偏低”“偏高”“不变”)

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O,
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时MnO
 被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO
 ,被还原成Mn2+。
,被还原成Mn2+。重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
回答下列小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)加入锌粉的目的是
(5)实验测得该晶体中铁的质量分数为
您最近一年使用:0次
7 . (1)在25 ℃时,两种酸的电离平衡常数如表:
①HSO 的电离平衡常数表达式K=
的电离平衡常数表达式K=___________ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________ 。
(2)某浓缩液中主要含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为
为___________ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)过氧化氢含量的测定实验
某兴趣小组同学用0.100 0 mol/L的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①高锰酸钾溶液应盛装在_________ (填“酸”或“碱”)式滴定管中。
②滴定达到终点的现象是_______________________________________ 。
③用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
计算试样中过氧化氢的浓度为________ mol/L。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.2×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
(2)某浓缩液中主要含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
 为
为(3)过氧化氢含量的测定实验
某兴趣小组同学用0.100 0 mol/L的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO
 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。①高锰酸钾溶液应盛装在
②滴定达到终点的现象是
③用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为
您最近一年使用:0次
2020-08-14更新
|
237次组卷
|
2卷引用:云南省峨山彝族自治县第一中学2019-2020学年高二下学期期末考试化学试题
名校
解题方法
8 . 完成下列实验,所用仪器或操作合理的是
| A | B | C | D |
| 配制250 mL 0.10 mol·L−1NaOH溶液 | 除去工业乙醇中的杂质 | 除去粗盐水中的不溶物 | 用标准NaOH溶液滴定锥形瓶中的盐酸 |
 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-11更新
|
437次组卷
|
4卷引用:云南省玉溪一中2021届高三上学期第二次月考化学试题
9 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____ (填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____ 。
③装置Ⅴ生成NOCl的化学方程式是_____ 。
④装置Ⅵ的作用为_____ ,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______ 。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________ (用代数式表示即可)。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
| 制备原料 | 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | 饱和食盐水 |
| 制备纯净NO | Cu | 稀硝酸 | ② |


①装置连接顺序为a→
②为了使实验顺利进行,实验中先通入的气体是
③装置Ⅴ生成NOCl的化学方程式是
④装置Ⅵ的作用为
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
2020-07-06更新
|
231次组卷
|
3卷引用:云南省大理、丽江、怒江2020届高中毕业生第二次复习统一检测理综化学试题
10 . 硫酸银(Ag2SO4)可用作分析试剂,测定亚硝酸盐、钒酸盐等,也可用作催化剂。为探究Ag2SO4的分解产物,某化学兴趣小组称取6.24gAg2SO4样品,按如图所示装置进行实验(加持装置略去)。

已知:氧化银(Ag2O)是棕褐色晶体或棕黑色粉末,不溶于水,易溶于酸和氨水。
请回答下列问题:
(1)部分实验步骤如下,操作先后排序为___ (用字母表示)。
a.点燃A处酒精灯
b.检查装置气密性
c.打开K1和K2,通入干燥的N2
d.装实验药品
(2)装置B中有白色沉淀生成,发生反应的离子方程式为___ 。
(3)①装置C中酸性KMnO4溶液颜色变浅,且装置D中___ (填选项字母)未发生颜色变化,证明产物中有SO2且全部被酸性KMnO4溶液吸收;装置E中的现象是___ ,证明有O2生成。
a.NaOH溶液
b.浓H2SO4
c.品红溶液
d.KSCN溶液
②反应完成后,将装置C中溶液倒入锥形瓶中,并用蒸馏水洗试剂瓶2~3次,将洗涤液一并倒入锥形瓶中;用0.75mol•L-1H2C2O4溶液滴定装置C中未与SO2反应的KMnO4,盛放H2C2O4溶液的仪器名称为___ 。
实验数据记录如下:
③生成SO2的物质的量为___ mol。
(4)称取Ag2SO4高温分解后固体物质的质量为4.32g,且不溶于氨水,证明固体产物是___ (填化学式)。
(5)硫酸银(Ag2SO4)高温分解反应的化学方程式为___ 。

已知:氧化银(Ag2O)是棕褐色晶体或棕黑色粉末,不溶于水,易溶于酸和氨水。
请回答下列问题:
(1)部分实验步骤如下,操作先后排序为
a.点燃A处酒精灯
b.检查装置气密性
c.打开K1和K2,通入干燥的N2
d.装实验药品
(2)装置B中有白色沉淀生成,发生反应的离子方程式为
(3)①装置C中酸性KMnO4溶液颜色变浅,且装置D中
a.NaOH溶液
b.浓H2SO4
c.品红溶液
d.KSCN溶液
②反应完成后,将装置C中溶液倒入锥形瓶中,并用蒸馏水洗试剂瓶2~3次,将洗涤液一并倒入锥形瓶中;用0.75mol•L-1H2C2O4溶液滴定装置C中未与SO2反应的KMnO4,盛放H2C2O4溶液的仪器名称为
实验数据记录如下:
| 实验 | 初始读数 | 最终读数 |
| I | 0.10 | 20.20 |
| II | 0.50 | 24.75 |
| III | 1.00 | 20.90 |
(4)称取Ag2SO4高温分解后固体物质的质量为4.32g,且不溶于氨水,证明固体产物是
(5)硫酸银(Ag2SO4)高温分解反应的化学方程式为
您最近一年使用:0次



