名校
解题方法
1 . 实验小组同学为探究Fe2+性质,进行如下实验。
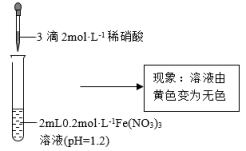
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
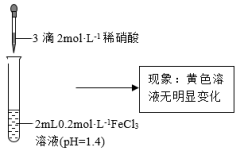
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
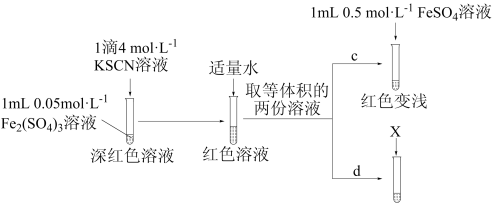
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应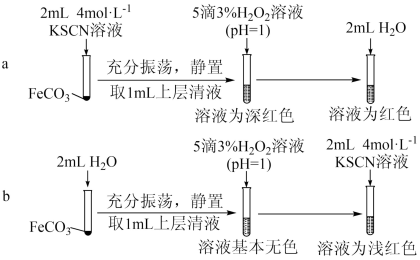
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2022-05-30更新
|
1318次组卷
|
11卷引用:北京市东城区2022届高三综合练习(二模)化学试题
北京市东城区2022届高三综合练习(二模)化学试题北京市育才学校2022届高三下学期三模化学试题北京市一零一中学2022届高三三模化学试题北京市北京一零一中学2022-2023学年高三上学期统练7化学试题北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)实验探究题北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题北京大学附属中学预科部2023-2024学年高三上学期12月阶段练习化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
2 . 碳酸氢钠是一种无机盐,在制药工业、食品加工、消防器材等方面有广泛的应用。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式_______ 。
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2 ⇌
⇌ +H2CO3,则该反应的平衡常数值为
+H2CO3,则该反应的平衡常数值为_______ (保留3位有效数字)。
II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
已知:Mg和H2O反应只能在Mg表面产生微量气泡, 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是_______ ,为控制变量与实验组1一致,应对实验组2进行改进,具体操作为_______ 。镁和NaHCO3溶液反应比镁和水反应速率快的原因可能是_______ 。
(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
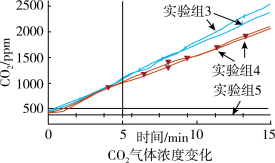
测量时取少量NaHCO3溶液、少量镁条的原因是_______ ;通过图象可以确定镁和NaHCO3溶液反应生成的气体为_______ 。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2
 ⇌
⇌ +H2CO3,则该反应的平衡常数值为
+H2CO3,则该反应的平衡常数值为II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
| 实验组1 | 6mLlmol/LNaHCO3溶液(pH=8.4) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mLlmol/LNaNO3溶液 | 镁表面微量气泡附着 |
 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
| 实验组3 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,但不加入镁条 |
| 实验组4 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,并加入0.1g打磨的镁条 |
| 实验组5 | 空塑料瓶 |

测量时取少量NaHCO3溶液、少量镁条的原因是
您最近一年使用:0次
3 . 重铬酸钾在工业中有广泛的应用,某学习小组模拟工业制备重铬酸钾并探究其性质。
I.制备重铬酸钾
以铬铁矿(主要成分可表示为 ,还含有
,还含有 等杂质)制备重铬酸钾(
等杂质)制备重铬酸钾( )固体的工艺流程如下:
)固体的工艺流程如下:
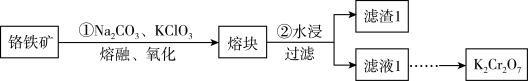
资料:ⅰ. 遇水强烈水解。
遇水强烈水解。
ⅱ.部分微粒在溶液中的颜色: 橙色
橙色 绿色
绿色
(1) 中
中 元素的化合价是
元素的化合价是___________ 。
(2)熔块的主要成分为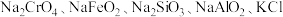 等可溶性盐,滤渣1为红褐色固体,写出步骤②
等可溶性盐,滤渣1为红褐色固体,写出步骤② 水解的离子方程式
水解的离子方程式___________ 。
(3)测定重铬酸钾纯度
称取重铬酸钾试样 配成
配成 溶液,取出
溶液,取出 于锥形瓶中,加入足量稀
于锥形瓶中,加入足量稀 和碘化钾溶液(
和碘化钾溶液( 的还原产物为
的还原产物为 ),放于暗处
),放于暗处 ,然后加入
,然后加入 水和淀粉指示剂,用
水和淀粉指示剂,用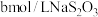 标准溶液滴定(
标准溶液滴定( ),至滴定终点消耗标准液
),至滴定终点消耗标准液 ,则所得产品中重铬酸钾的纯度:
,则所得产品中重铬酸钾的纯度:___________ 。(滴定过程中其他杂质不参与反应)
II.探究重铬酸钾的性质
(4)由上述I、II、III实验现象,甲同学认为可以确认 在实验Ⅲ中起
在实验Ⅲ中起_________ 作用;
乙同学认为还应该补充实验V才能证明 的上述作用,实验V的操作和现象是:
的上述作用,实验V的操作和现象是:_____ 。
(5)查阅资料可知,在反应III中 ,使双氧水分解反应分步进行,其过程可表示为:
,使双氧水分解反应分步进行,其过程可表示为:
ⅰ: ;
;
ⅱ:…
请写出反应ⅱ的离子方程式:___________ 。
(6)写出实验Ⅳ中反应的离子方程式:___________ 。
综上所述, 的性质还与溶液的酸碱性等因素有关。
的性质还与溶液的酸碱性等因素有关。
I.制备重铬酸钾
以铬铁矿(主要成分可表示为
 ,还含有
,还含有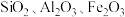 等杂质)制备重铬酸钾(
等杂质)制备重铬酸钾( )固体的工艺流程如下:
)固体的工艺流程如下:
资料:ⅰ.
 遇水强烈水解。
遇水强烈水解。ⅱ.部分微粒在溶液中的颜色:
 橙色
橙色 绿色
绿色(1)
 中
中 元素的化合价是
元素的化合价是(2)熔块的主要成分为
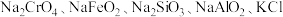 等可溶性盐,滤渣1为红褐色固体,写出步骤②
等可溶性盐,滤渣1为红褐色固体,写出步骤② 水解的离子方程式
水解的离子方程式(3)测定重铬酸钾纯度
称取重铬酸钾试样
 配成
配成 溶液,取出
溶液,取出 于锥形瓶中,加入足量稀
于锥形瓶中,加入足量稀 和碘化钾溶液(
和碘化钾溶液( 的还原产物为
的还原产物为 ),放于暗处
),放于暗处 ,然后加入
,然后加入 水和淀粉指示剂,用
水和淀粉指示剂,用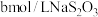 标准溶液滴定(
标准溶液滴定( ),至滴定终点消耗标准液
),至滴定终点消耗标准液 ,则所得产品中重铬酸钾的纯度:
,则所得产品中重铬酸钾的纯度:II.探究重铬酸钾的性质
| 实验 | I | II | III | IV |
| 操作 | 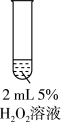 | 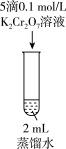 | 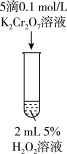 | 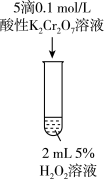 |
| 现象 | 溶液中略有微小气泡产生 | 溶液颜色变为浅黄色 | 试管中溶液立即变为棕褐色,一段时间后,逐渐产生大量使带火星木条复燃的气体,溶液颜色慢慢变浅, 后溶液颜色与实验II试管中颜色几乎相同 后溶液颜色与实验II试管中颜色几乎相同 | 迅速反应,溶液颜色变为绿色,并产生大量使带火星木条复燃的气体 |
 在实验Ⅲ中起
在实验Ⅲ中起乙同学认为还应该补充实验V才能证明
 的上述作用,实验V的操作和现象是:
的上述作用,实验V的操作和现象是:(5)查阅资料可知,在反应III中
 ,使双氧水分解反应分步进行,其过程可表示为:
,使双氧水分解反应分步进行,其过程可表示为:ⅰ:
 ;
;ⅱ:…
请写出反应ⅱ的离子方程式:
(6)写出实验Ⅳ中反应的离子方程式:
综上所述,
 的性质还与溶液的酸碱性等因素有关。
的性质还与溶液的酸碱性等因素有关。
您最近一年使用:0次
2022-04-23更新
|
561次组卷
|
2卷引用:北京市通州区2022届高三一模化学试题
名校
4 . 某小组研究溶液中 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用_______ 溶液检出溶液中含有 ,现象是
,现象是_______ 。
②甲认为是 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是_______ 。另行设计实验Ⅱ进行验证,确认是酸性条件下 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式_______ 。
(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。
①实验Ⅲ的操作和现象是_______ 。
②写出该反应的离子方程式_______ 。
(3)研究酸性条件下,溶液中 与
与 、
、 的反应。
的反应。
ⅲ中出现棕色的原因是_______ 。
(4)实验结论:_______ (至少写出两条)
 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。| 实验Ⅰ | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 |   溶液 溶液(  ) ) |   溶液 溶液(  ) ) | a.逐滴加入 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 |
  溶液(加NaOH溶液至 溶液(加NaOH溶液至 ) ) | b.逐滴加入 溶液至1mL,无明显变化。 溶液至1mL,无明显变化。 | ||
 在溶液中呈棕色。
在溶液中呈棕色。(1)研究现象a中的黄色溶液。
①用
 ,现象是
,现象是②甲认为是
 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的
 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。①实验Ⅲ的操作和现象是
②写出该反应的离子方程式
(3)研究酸性条件下,溶液中
 与
与 、
、 的反应。
的反应。| 序号 | 操作 | 现象 |
| ⅰ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 溶液立即变为棕色 |
| ⅱ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 无明显变化 |
| ⅲ | 分别取1mL  的 的 溶液与1mL 溶液与1mL  的 的 溶液混合,再加入一滴浓硫酸(混合后溶液 溶液混合,再加入一滴浓硫酸(混合后溶液 ) ) | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
(4)实验结论:
您最近一年使用:0次
2022-04-04更新
|
689次组卷
|
4卷引用:北京市一零一中学2021-2022学年高一上学期期末考试化学试题
北京市一零一中学2021-2022学年高一上学期期末考试化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)湖南省五市十校教研教改共同体2021-2022学年高一下学期期末考试化学试题湖南省长沙市实验中学2022-2023学年高二上学期入学考试化学试题
名校
解题方法
5 . 硫化氢的回收、转化是环境保护和资源利用的重要研究课题。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是____ 。
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是_____ 。
b.加入CH3COONa后得到大量ZnS沉淀的原因是____ 。
②沉淀氧化法。过程如图所示:
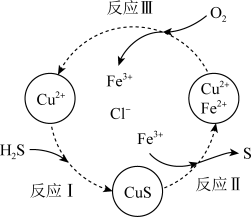
a.反应Ⅱ的离子方程式是____ 。
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii._____ (将反应ii补充完整)
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____ 。
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。
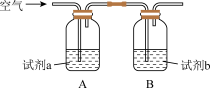
i.试剂a是___ ,试剂b是___ 。
ii.Cu2+提高反应Ⅲ速率的实验证据是____ 。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是
b.加入CH3COONa后得到大量ZnS沉淀的原因是
②沉淀氧化法。过程如图所示:

a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。

i.试剂a是
ii.Cu2+提高反应Ⅲ速率的实验证据是
您最近一年使用:0次
6 . 某学习小组探究 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
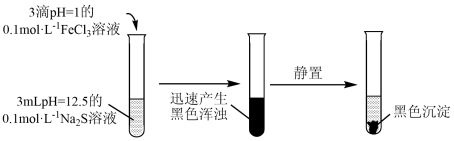
已知:FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
(1) 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是___________ (用化学用语回答)。
(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是
①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式___________ 。经检验后确认黑色沉淀中无S单质,猜想1不成立。
②乙同学根据 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。
向 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。
该实验现象能确定的结论是___________ ;不能确定的是___________ 。
(3)丙同学利用电化学原理继续进行探究并设计实验:
丙同学依据实验得出结论:pH=1的0.1mol/L  溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,分析试管b中黑色沉淀是 而不是FeS的原因
而不是FeS的原因___________ 。
 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、
 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。(1)
 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是

①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式
②乙同学根据
 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。向
 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。该实验现象能确定的结论是
(3)丙同学利用电化学原理继续进行探究并设计实验:
| 装置 | 操作及现象 |
 | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加  溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有大量蓝色沉淀。 溶液,有大量蓝色沉淀。 |
 溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液(4)综合以上研究,分析试管b中黑色沉淀是
 而不是FeS的原因
而不是FeS的原因
您最近一年使用:0次
解题方法
7 . 实验小组用固体和水配制相同浓度的 溶液和
溶液和 溶液,用其研究
溶液,用其研究 的性质。
的性质。
【查阅资料】 (黄色)
(黄色)
(1) 溶于水后促进了水的电离,实验证据是
溶于水后促进了水的电离,实验证据是___________ 。
(2)根据实验Ⅰ推测, 溶液呈现黄色的原因可能是
溶液呈现黄色的原因可能是 水解所致。结合化学用语分析该推测过程:
水解所致。结合化学用语分析该推测过程:___________
(3)为了证明 溶液中存在平衡:
溶液中存在平衡: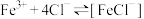 ,同学们设计并进行实验。
,同学们设计并进行实验。
能说明 溶液中存在上述平衡的实验方案是
溶液中存在上述平衡的实验方案是___________ (填字母)。
(4)综合上述实验,分析相同浓度 溶液的
溶液的 大于
大于 溶液的
溶液的 ,原因是
,原因是___________ 。
 溶液和
溶液和 溶液,用其研究
溶液,用其研究 的性质。
的性质。| 实验Ⅰ | 实验Ⅱ |
 |  |
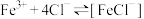 (黄色)
(黄色)(1)
 溶于水后促进了水的电离,实验证据是
溶于水后促进了水的电离,实验证据是(2)根据实验Ⅰ推测,
 溶液呈现黄色的原因可能是
溶液呈现黄色的原因可能是 水解所致。结合化学用语分析该推测过程:
水解所致。结合化学用语分析该推测过程:(3)为了证明
 溶液中存在平衡:
溶液中存在平衡: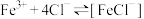 ,同学们设计并进行实验。
,同学们设计并进行实验。| 序号 | 实验操作 | 实验现象 |
| a | 向 溶液中加入铁粉 溶液中加入铁粉 | 溶液颜色变浅 |
| b | 向 溶液中加入3滴 溶液中加入3滴 溶液 溶液 | 产生白色沉淀,溶液颜色变浅 |
| c | 向实验Ⅱ所得溶液中加入3滴NaOH | 产生红褐色沉淀,溶液颜色变浅 |
| d | 将 溶液加热 溶液加热 | 溶液颜色变深 |
 溶液中存在上述平衡的实验方案是
溶液中存在上述平衡的实验方案是(4)综合上述实验,分析相同浓度
 溶液的
溶液的 大于
大于 溶液的
溶液的 ,原因是
,原因是
您最近一年使用:0次
名校
解题方法
8 . 盐酸和醋酸是生活中常用的酸。某实验小组进行了以下实验。
(1)对比盐酸和醋酸与NaOH的反应。常温下,用0.1000mol·L−1NaOH溶液分别滴定20mL0.1000mol·L−1的盐酸和醋酸,滴定过程中溶液pH的变化曲线如下图所示。
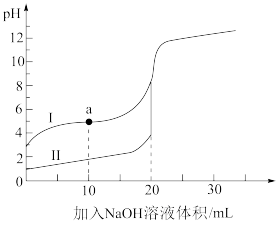
①表示滴定盐酸的曲线是_______ (填“I”或“II”)。
②a点溶液中,离子浓度由大到小的顺序为_______ 。
③V[NaOH(aq)]=20mL时,c(Cl−)_______ c(CH3COO−)(填“>”“<”或“=”)。
(2)对比盐酸和醋酸与NaClO的反应。资料:25℃时CH3COOH和HClO的电离平衡常数Ka分别为1.75×10−5和4.0×10−8。
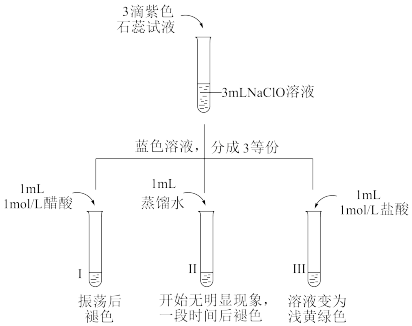
①NaClO溶液中加入石蕊溶液变蓝,用化学用语解释原因_______ 。
②实验II的目的是_______ 。
③结合资料和化学用语解释I的实验现象_______ 。
④III中溶液变为浅黄绿色,用离子方程式解释原因_______ 。
(1)对比盐酸和醋酸与NaOH的反应。常温下,用0.1000mol·L−1NaOH溶液分别滴定20mL0.1000mol·L−1的盐酸和醋酸,滴定过程中溶液pH的变化曲线如下图所示。

①表示滴定盐酸的曲线是
②a点溶液中,离子浓度由大到小的顺序为
③V[NaOH(aq)]=20mL时,c(Cl−)
(2)对比盐酸和醋酸与NaClO的反应。资料:25℃时CH3COOH和HClO的电离平衡常数Ka分别为1.75×10−5和4.0×10−8。

①NaClO溶液中加入石蕊溶液变蓝,用化学用语解释原因
②实验II的目的是
③结合资料和化学用语解释I的实验现象
④III中溶液变为浅黄绿色,用离子方程式解释原因
您最近一年使用:0次
2022-01-19更新
|
221次组卷
|
3卷引用:北京市朝阳区2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,发生反应的离子方程式是___________ 。
(2)将氯气通入NaOH溶液中制备得到“84”消毒液,同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤:将市售“84”消毒液各20mL分别加入3个洁净的小烧杯中;
用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
溶液中Cl2、HClO和ClO—物质的量分数(α)随溶液pH变化的关系如图所示:

已知:pH越大,溶液中的c(H+)越小,结合图象进行分析,开始时c烧杯中比b烧杯中褪色快的原因是___________ ,反应速率较快。
(3)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为_______ 。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占 ,每生成0.5molClO2,转移
,每生成0.5molClO2,转移___________ mole-。
(1)将氯气通入水中制得氯水,发生反应的离子方程式是
(2)将氯气通入NaOH溶液中制备得到“84”消毒液,同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤:将市售“84”消毒液各20mL分别加入3个洁净的小烧杯中;
用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |

已知:pH越大,溶液中的c(H+)越小,结合图象进行分析,开始时c烧杯中比b烧杯中褪色快的原因是
(3)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占
 ,每生成0.5molClO2,转移
,每生成0.5molClO2,转移
您最近一年使用:0次
名校
解题方法
10 . 某小组同学对 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。
(1)测得 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因___________ 。
(2)调节 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:
资料:ⅰ. :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。
ⅱ. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
针对实验 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:
推测1:白色沉淀为 。
。
推测2:白色沉淀为 。
。
①推测1产生该沉淀的反应用离子方程式表示___________ 。
②推测2的理论依据是___________ 。
③取 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)为确认 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;
Ⅲ.用 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①Ⅰ的目的是___________ 。
②根据Ⅲ的现象,可判断 的元素组成
的元素组成___________ 。
③Ⅱ中反应的化学方程式是___________ 。
(4)综合以上实验,分析 产生的可能原因:
产生的可能原因:
①甲同学认为随着溶液酸性增强, 中的
中的 氧化性增强。
氧化性增强。
②乙同学认为___________ 。
 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。(1)测得
 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因(2)调节
 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:| 实验 |  | 现象 |
 | 10 | 产生白色沉淀,稍后沉淀溶解 |
 | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
 | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
 :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。ⅱ.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。针对实验
 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:推测1:白色沉淀为
 。
。推测2:白色沉淀为
 。
。①推测1产生该沉淀的反应用离子方程式表示
②推测2的理论依据是
③取
 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于(3)为确认
 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;Ⅲ.用
 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①Ⅰ的目的是
②根据Ⅲ的现象,可判断
 的元素组成
的元素组成③Ⅱ中反应的化学方程式是
(4)综合以上实验,分析
 产生的可能原因:
产生的可能原因:①甲同学认为随着溶液酸性增强,
 中的
中的 氧化性增强。
氧化性增强。②乙同学认为
您最近一年使用:0次
2021-10-19更新
|
692次组卷
|
2卷引用:北京市北京中国人民大学附属中学2022届高三10月检测化学试卷



