名校
1 . 硫酸盐在工农业生产中具有重要作用,某校同学进行如下探究实验:
Ⅰ.硫酸钙主要用作吸湿剂、干燥剂、增稠剂等。兴趣小组同学对一氧化碳与硫酸钙的反应进行探究。
(1)甲同学利用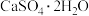 在400~500℃脱水制取无水
在400~500℃脱水制取无水 ;利用
;利用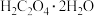 在浓硫酸作用下脱水生成CO、
在浓硫酸作用下脱水生成CO、 并制备纯净、干燥的CO气体,实验装置如图所示:
并制备纯净、干燥的CO气体,实验装置如图所示:

B、C中盛放的试剂依次为_______ 、_______ 。
(2)乙同学利用甲同学制得的无水 和CO进行反应,并用下列装置检验气态产物中有
和CO进行反应,并用下列装置检验气态产物中有 和
和 生成。
生成。

①上述装置(部分装置可重复使用)的正确连接顺序为C→_______ 。
②若E中溶液褪色,则E中发生反应的离子方程式为_______ 。
③能证明有 生成的实验依据是
生成的实验依据是_______ 。
(3)丙同学取乙同学实验后G装置中的固体产物于试管中,加入足量稀盐酸,固体完全溶解且产生少量气体,将气体通入 溶液中,有黑色沉淀生成,可验证CO与
溶液中,有黑色沉淀生成,可验证CO与 在高温下还发生了一个副反应,该副反应的化学方程式为
在高温下还发生了一个副反应,该副反应的化学方程式为_______ 。
Ⅱ.胆矾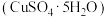 具有催吐、祛腐、解毒等作用,在不同温度下分解情况不同。取5.00g该晶体在密闭容器中进行实验,测得分解后剩余固体质量与温度的关系如图所示。
具有催吐、祛腐、解毒等作用,在不同温度下分解情况不同。取5.00g该晶体在密闭容器中进行实验,测得分解后剩余固体质量与温度的关系如图所示。
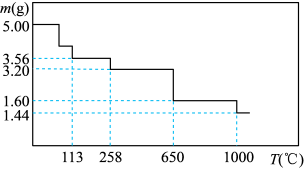
(4)113℃分解得到的固体产物为_______ 。
Ⅰ.硫酸钙主要用作吸湿剂、干燥剂、增稠剂等。兴趣小组同学对一氧化碳与硫酸钙的反应进行探究。
(1)甲同学利用
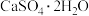 在400~500℃脱水制取无水
在400~500℃脱水制取无水 ;利用
;利用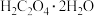 在浓硫酸作用下脱水生成CO、
在浓硫酸作用下脱水生成CO、 并制备纯净、干燥的CO气体,实验装置如图所示:
并制备纯净、干燥的CO气体,实验装置如图所示:
B、C中盛放的试剂依次为
(2)乙同学利用甲同学制得的无水
 和CO进行反应,并用下列装置检验气态产物中有
和CO进行反应,并用下列装置检验气态产物中有 和
和 生成。
生成。
①上述装置(部分装置可重复使用)的正确连接顺序为C→
②若E中溶液褪色,则E中发生反应的离子方程式为
③能证明有
 生成的实验依据是
生成的实验依据是(3)丙同学取乙同学实验后G装置中的固体产物于试管中,加入足量稀盐酸,固体完全溶解且产生少量气体,将气体通入
 溶液中,有黑色沉淀生成,可验证CO与
溶液中,有黑色沉淀生成,可验证CO与 在高温下还发生了一个副反应,该副反应的化学方程式为
在高温下还发生了一个副反应,该副反应的化学方程式为Ⅱ.胆矾
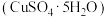 具有催吐、祛腐、解毒等作用,在不同温度下分解情况不同。取5.00g该晶体在密闭容器中进行实验,测得分解后剩余固体质量与温度的关系如图所示。
具有催吐、祛腐、解毒等作用,在不同温度下分解情况不同。取5.00g该晶体在密闭容器中进行实验,测得分解后剩余固体质量与温度的关系如图所示。
(4)113℃分解得到的固体产物为
您最近一年使用:0次
2022-07-07更新
|
529次组卷
|
3卷引用:吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题
2 . 硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)都是重要的化工试剂,均易水解。
(1)甲同学在实验室利用SO2和Cl2在活性炭催化作用下制取SO2Cl2,装置如图所示。

①B装置中冷凝管进水口是___________ (填“m”或“n”)。B中干燥管盛有的物质是___________ 。
②欲制取少量SO2Cl2,选择上图装置(可重复选用),其连接顺序为:a、___________ 、h(用小写字母表示)。
③去除C装置会降低SO2和Cl2的利用率,可能的原因是___________ 。(用化学方程式表示)
(2)SOCl2水解后无残留物,较SO2Cl2是更好的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用是___________ 。
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是___________ 。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯。
两同学设计如下实验判断副反应的可能性:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水溶解,将溶液平分至五支试管,分别进行以下实验,其中能得出合理结论的是___________ 。
A.加入过量稀HNO3,再滴加几滴AgNO3溶液
B.加入少量稀HNO3,再滴加几滴BaCl2溶液
C.滴加几滴BaCl2溶液
D.滴加几滴酸性KMnO4溶液
E.滴加几滴KSCN溶液后,再滴加几滴氯水
(1)甲同学在实验室利用SO2和Cl2在活性炭催化作用下制取SO2Cl2,装置如图所示。

①B装置中冷凝管进水口是
②欲制取少量SO2Cl2,选择上图装置(可重复选用),其连接顺序为:a、
③去除C装置会降低SO2和Cl2的利用率,可能的原因是
(2)SOCl2水解后无残留物,较SO2Cl2是更好的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用是
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯。
两同学设计如下实验判断副反应的可能性:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水溶解,将溶液平分至五支试管,分别进行以下实验,其中能得出合理结论的是
A.加入过量稀HNO3,再滴加几滴AgNO3溶液
B.加入少量稀HNO3,再滴加几滴BaCl2溶液
C.滴加几滴BaCl2溶液
D.滴加几滴酸性KMnO4溶液
E.滴加几滴KSCN溶液后,再滴加几滴氯水
您最近一年使用:0次
3 . 浓硫酸分别和三种钠盐反应,下列分析正确的是
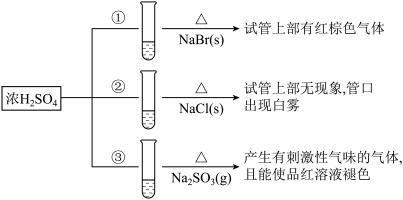
| A.对比①和②可以说明还原性Br->Cl- |
| B.①和③相比可说明氧化性Br2>SO2 |
| C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl |
| D.③中浓H2SO4被还原成SO2 |
您最近一年使用:0次
2020-11-07更新
|
1201次组卷
|
33卷引用:吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 2016-2017学年甘肃省天水市第一中学高一下学期第一阶段考试化学试卷上海市徐汇区2018届高三化学二模试卷(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质山西大学附中2020届高三上学期第二次模块诊断化学试题安徽省怀宁中学2020届高三上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的基本概念(基础过关)山东省淄博市2020届高三下学期第二次网考化学试题山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)广东省汕头市金山中学2021届高三下学期学科素养测试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高一下学期第一次考试化学试题河北省承德市隆化县存瑞中学2020-2021学年高二下学期期末联考化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省双鸭山市第一中学2020-2021学年高一下学期第一次月考化学试题新疆哈密市第十五中学2021-2022学年高三上学期第一次月考化学试题山东省泰安市2021-2022年高三上学期期中统考化学试题山东省泰安市2022届高三上学期期中考试化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)上海外国语大学附属浦东外国语学校2021-2022学年高一下学期线上诊断化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题上海市川沙中学2020-2021学年高一下学期期中线上测试化学试题广州大学附属中学2021-2022学年高一下学期5月月考化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.1.2 浓硫酸和硫酸盐-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题(已下线)第15讲 硫酸-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 浓硫酸 不同价态含硫物质的转化上海市川沙中学2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
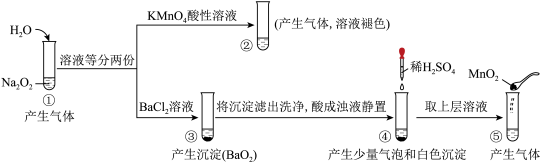
4 . 探究Na2O2与水的反应,实验如图:(已知:H2O2 H++
H++ 、
、
 H++
H++ )下列分析不正确的是
)下列分析不正确的是
 H++
H++ 、
、
 H++
H++ )下列分析不正确的是
)下列分析不正确的是
| A.①、⑤中产生的气体能使带火星的木条复燃 |
| B.①、④中均发生了氧化还原反应和复分解反应 |
| C.②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同 |
| D.通过③能比较酸性:HCl>H2O2 |
您最近一年使用:0次
2020-09-03更新
|
1144次组卷
|
27卷引用:吉林省吉林实验中学2021-2022学年上学期高三第一次诊断测试化学试题
吉林省吉林实验中学2021-2022学年上学期高三第一次诊断测试化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题湖南省衡阳市第八中学2020届高三第三次月考化学试题河北省辛集中学2020届高三上学期期中考试化学试题河北省衡水市衡水中学2019-2020学年高三上学期期中考试化学试题(已下线)考点05 典型金属元素及其化合物——《备战2020年高考精选考点专项突破题集》甘肃省张掖市第二中学2020届高三上学期9月月考化学试题湖北省黄冈市浠水县实验高级中学2020届高三8月月考化学试题2019年秋高三化学复习强化练习—— 物质的性质探究实验湖南师范大学附属中学2020届高三第五次月考化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编安徽省合肥市肥东县高级中学2020届高三5月调研考试理科综合化学试题安徽省肥东县高级中学2020届高三6月调研考试理科综合化学试题(已下线)第九单元 化学实验基础测试题-2021年高考化学一轮复习名师精讲练浙江大学附属中学 2019 年选考科目阶段性教学质量检测高三化学(B 卷)试题(已下线)1.2.1 研究物质性质的方法-2020-2021学年高一化学课时同步练(鲁科2019必修第一册)山东省临沂市莒南第二中学2021届高三10月月考化学试题(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测河北省衡水市第十四中学2021-2022学年(2022届)高三上学期一调考试化学试题河南省南阳市内乡县菊潭高级中学2022届高三入学考试化学试题(已下线)【教材实验热点】02 金属钠性质的研究上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题北京市第十二中学2022-2023学年高一上学期期中考试化学试题新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题辽宁省沈阳市第一二〇中学2022-2023学年高二下学期期末考试化学试题甘肃省天水市2023-2024学年高一上学期10月份化学竞赛试卷 2019-2020广东省广州市广州中学高三10月考试化学试卷
名校
5 . 用如图所示实验装置进行相关实验探究,下列说法不合理的是

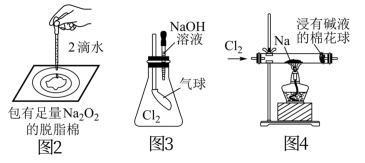


| A.图1若二氧化锰过量,则浓盐酸可全部反应完 |
| B.图2证明Na2O2与水反应放热 |
| C.图3证明Cl2能与烧碱溶液反应 |
| D.图4探究钠与Cl2反应 |
您最近一年使用:0次
2022-01-05更新
|
289次组卷
|
2卷引用:吉林省吉林松花江中学2022-2023学年高一上学期1月期末考试化学试题
解题方法
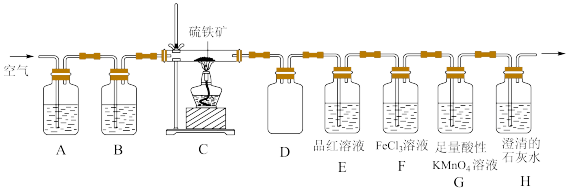
6 . 某同学为了验证硫铁矿(主要成分为FeS2。含有少量的碳)焙烧产物(产生的气体是SO2,CO2),设计如下装置进行实验:
回答下列问题:
(1)装置A、B中的试剂分别是_______ 、_______ 。
(2)装置D的作用是_______ 。
(3)验证焙烧后气体产物的实验现象分别为_______ 、_______ ;若F中颜色发生改变,写出产生颜色变化反应的离子方程式:_______ 。取F中反应后的溶液于洁净的试管中。滴加少量KSCN溶液,溶液不变红,说明溶液中_______ (填“含有”或“不含有”)Fe3+;再继续滴加少量氯水,溶液也不变红。产生这种现象的原因可能是_______ 。
(4)G中盛放足量酸性KMnO4溶液的目的是_______ (用离子方程式表示)。
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:_______ 。

回答下列问题:
(1)装置A、B中的试剂分别是
(2)装置D的作用是
(3)验证焙烧后气体产物的实验现象分别为
(4)G中盛放足量酸性KMnO4溶液的目的是
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:
您最近一年使用:0次
7 . 实验室制取并收集氯气的装置如图所示,请回答下列问题
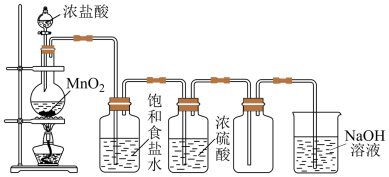
(1)气体发生装置中进行的反应化学方程式是______ 。
(2)在装置中:①饱和食盐水的作用是______ ,②浓硫酸的作用是______ 。
(3)化学实验中检验是否有 产生常用湿润的淀粉
产生常用湿润的淀粉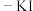 试纸
试纸 如果有
如果有 产生,可观察到的现象是
产生,可观察到的现象是______ 。
(4)写出尾气吸收装置中进行的反应的离子方程式______ 。

(1)气体发生装置中进行的反应化学方程式是
(2)在装置中:①饱和食盐水的作用是
(3)化学实验中检验是否有
 产生常用湿润的淀粉
产生常用湿润的淀粉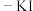 试纸
试纸 如果有
如果有 产生,可观察到的现象是
产生,可观察到的现象是(4)写出尾气吸收装置中进行的反应的离子方程式
您最近一年使用:0次
2020-04-26更新
|
915次组卷
|
3卷引用:吉林油田第十一中学2020-2021学年高一上学期期中考试化学试题
名校
8 . 氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。_______ ;装置B内的试剂是_______ 。
②装置D中发生反应的离子方程式是_______ ,铜丝可抽动的优点是_______ 。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为_______ 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
用NaOH溶液吸收氮氧化物的最佳条件为:α=_______ ,c(NaOH)=_______ 。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为_______ 。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
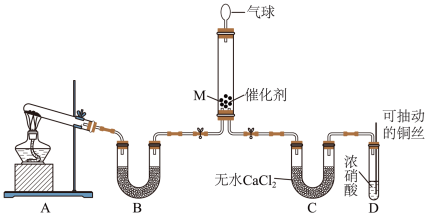
②装置D中发生反应的离子方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:
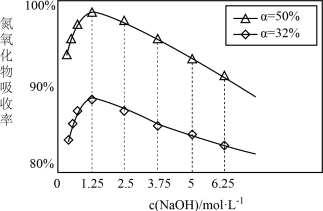
用NaOH溶液吸收氮氧化物的最佳条件为:α=
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为
您最近一年使用:0次
2021-08-23更新
|
740次组卷
|
11卷引用:吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 山东省聊城市2020-2021学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题山东省临沂第一中学2021-2022学年高一下学期第二次教学检测(4月线上)化学试题河北省定州市第二中学2021-2022学年高一下学期期末考试化学试题河北省石家庄精英中学2022-2023高二上学期开学考试化学试题陕西西安三中2022-2023学年高一下学期第二次月考化学试题“贵百河”2023-2024学年高二上学期10月新高考月考测试化学试题广东省高州市第四中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题广州市第七十五中学2023-2024学年高一下学期第一次阶段考试化学试题
2019高三·全国·专题练习
名校
解题方法
9 . 用如图所示装置进行下列实验:将①中浓硫酸溶液滴入②中。预测的现象与结论相符的是
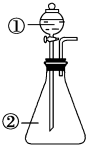

| 选项 | ② | 预测②中现象 | 实验结论 |
| A | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-02更新
|
545次组卷
|
14卷引用:吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题
吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测四川省雅安中学2020-2021学年高一下学期4月月考化学试题合肥市第九中学2020-2021学年高一下学期期中考试化学试题辽宁省大连市第一中学2020-2021学年高一下学期4月月考化学试题河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题河南省叶县高级中学2021-2022学年高一下学期5月质量检测化学试题湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题新疆精河县高级中学2021-2022学年高一下学期期中考试化学试题广东省江门市第一中学2021-2022学年高一下学期第一次月考化学试题(已下线)题型51 浓硫酸的性质广东省佛山市第四中学2022-2023学年高一下学期3月月考化学试卷山西省实验中学2022-2023学年高一下学期3月月考化学试题
10 . 某小组探究Cu与 反应,发现有趣的现象,室温下3mol/L的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
反应,发现有趣的现象,室温下3mol/L的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
探究溶液B遇铜片立即发生反应的原因。
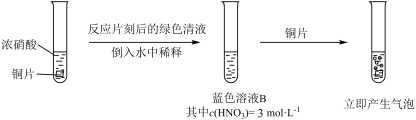
①假设1:___________ 对该反应有催化作用。
实验验证:将溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
方案Ⅰ 向盛有铜片的溶液A中通入少量 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol/L的硝酸,没有明显变化。补充该实验的目的是
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol/L的硝酸,没有明显变化。补充该实验的目的是___________ 。
方案Ⅱ 向溶液B中通入氮气数分钟得溶液C.相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,该实验能够证明假设2成立的理由是___________ 。
③查阅资料: 溶于水可以生成
溶于水可以生成 和
和___________ 。
向盛有铜片的溶液A中加入___________ ,铜片上立即产生气泡,证明 对该反应也有催化作用。
对该反应也有催化作用。
结论: 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。
④Cu与稀 反应中,
反应中, 参与的可能催化过程如下:将ⅱ补充完整。
参与的可能催化过程如下:将ⅱ补充完整。
i.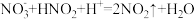
ⅱ.___________
ⅲii.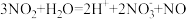
 反应,发现有趣的现象,室温下3mol/L的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。
反应,发现有趣的现象,室温下3mol/L的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(见图)遇铜片立即产生气泡。探究溶液B遇铜片立即发生反应的原因。

①假设1:
实验验证:将溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。方案Ⅰ 向盛有铜片的溶液A中通入少量
 ,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol/L的硝酸,没有明显变化。补充该实验的目的是
,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol/L的硝酸,没有明显变化。补充该实验的目的是方案Ⅱ 向溶液B中通入氮气数分钟得溶液C.相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,该实验能够证明假设2成立的理由是
③查阅资料:
 溶于水可以生成
溶于水可以生成 和
和向盛有铜片的溶液A中加入
 对该反应也有催化作用。
对该反应也有催化作用。结论:
 和
和 均对Cu与
均对Cu与 的反应有催化作用。
的反应有催化作用。④Cu与稀
 反应中,
反应中, 参与的可能催化过程如下:将ⅱ补充完整。
参与的可能催化过程如下:将ⅱ补充完整。i.
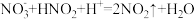
ⅱ.
ⅲii.
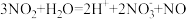
您最近一年使用:0次
2021-07-13更新
|
530次组卷
|
2卷引用:吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题



