解题方法
1 . 浓盐酸和高锰酸钾在室温下即可制备氯气,用如图装置制备少量的氯气并探究其性质。下列实验装置和操作能达到实验目的的是
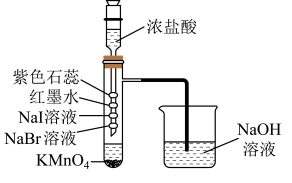

| A.根据溴化钠和碘化钠中的现象可证明氧化性:Br2<I2 |
| B.红墨水褪色,说明氯水具有漂白性 |
| C.紫色石蕊试液先变红后褪色,说明氯气具有酸性和强氧化性 |
| D.可用饱和食盐水代替NaOH溶液吸收多余的氯气 |
您最近一年使用:0次
2 . 某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:
(1)用下图装置制取并收集SO2以验证其氧化性
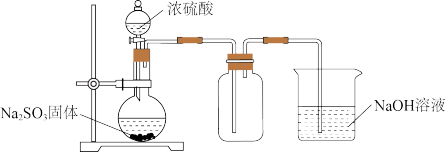
①Na2SO3久置于空气中易变质,体现了Na2SO3具有___________ 性。
②烧杯中NaOH溶液的作用是___________ 。
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为___________ 。
(2)用下图装置验证H2SO3比H2CO3酸性强
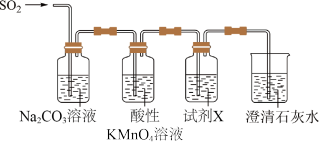
①试剂X是___________ ,其作用是___________ 。
②当观察到___________ ,即证明H2SO3比H2CO3酸性强。
(1)用下图装置制取并收集SO2以验证其氧化性

①Na2SO3久置于空气中易变质,体现了Na2SO3具有
②烧杯中NaOH溶液的作用是
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为
(2)用下图装置验证H2SO3比H2CO3酸性强

①试剂X是
②当观察到
您最近一年使用:0次
2020-12-17更新
|
506次组卷
|
4卷引用:江苏省赣榆第一中学2020-2021学年高一1月月考化学试题
3 . 某化学小组探究影响金属与水反应剧烈程度的因素。
【查阅资料】Mg能与水反应生成难溶的Mg(OH)2和H2;向水中加入NH4Cl溶液可以加快Mg与水的反应。
【实验过程与现象】
(1)分别将等质量的Na块和Mg条(打磨光亮)投入水中,记录现象如下。
①Na与水反应的离子方程式:___________ ;能证明该反应为放热反应的实验现象是___________ 。
②Mg与水反应数分钟后停止的原因可能是___________ 。
(2)探究NH4Cl加快Mg与水反应的原因。
取两根与水反应后的Mg条分别投入等体积等浓度的两种盐溶液中进行对比实验,结果如下。
①上表中能够说明 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是___________ 。
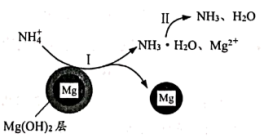
②经检验,实验a中还生成少量的NH3、为了解释 能促进Mg与水的反应及NH3产生的原因,化学小组提出了如图所示假设。写出反应I的离子方程式:
能促进Mg与水的反应及NH3产生的原因,化学小组提出了如图所示假设。写出反应I的离子方程式:___________ 。
【总结与反思】
(3)实验表明:与水反应的剧烈程度K>Na>Ca>Mg。结合上述实验说明影响金属与水反应剧烈程度的因素有___________ 。
【查阅资料】Mg能与水反应生成难溶的Mg(OH)2和H2;向水中加入NH4Cl溶液可以加快Mg与水的反应。
【实验过程与现象】
(1)分别将等质量的Na块和Mg条(打磨光亮)投入水中,记录现象如下。
| Na块在水中剧烈反应,浮在水面上,熔成小球,四处游动,发出响声,直至消失 | Mg条表面缓慢产生少量气泡,数分钟后反应停止,未收集到气体,镁条表面失去光泽 |
②Mg与水反应数分钟后停止的原因可能是
(2)探究NH4Cl加快Mg与水反应的原因。
取两根与水反应后的Mg条分别投入等体积等浓度的两种盐溶液中进行对比实验,结果如下。
| 实验序号 | a | b |
| 盐溶液(均为0.1 mol•L-1) | NH4Cl | NaCl |
| 30min时产生气体体积(mL) | 1.5 | <0.1 |
| 气体的主要成分 | H2 | |
 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是②经检验,实验a中还生成少量的NH3、为了解释
 能促进Mg与水的反应及NH3产生的原因,化学小组提出了如图所示假设。写出反应I的离子方程式:
能促进Mg与水的反应及NH3产生的原因,化学小组提出了如图所示假设。写出反应I的离子方程式:
【总结与反思】
(3)实验表明:与水反应的剧烈程度K>Na>Ca>Mg。结合上述实验说明影响金属与水反应剧烈程度的因素有
您最近一年使用:0次
2021-01-27更新
|
177次组卷
|
2卷引用:江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题
4 . 某化学实验小组为探究SO2、Cl2的性质,并比较SO2和氯水的漂白性,设计了如下的实验。
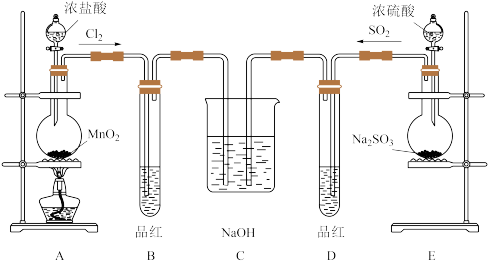
(1)图中盛放浓盐酸仪器的名称为___ ,装置A中发生反应的化学方程式___ 。
(2)反应一段时间后,B、D中品红褪色。反应结束后,分别加热B、D中的试管,可观察到的现象为:B___ 、D___ 。
(3)C装置的作用是吸收尾气,写出SO2与足量NaOH溶液反应的离子方程式:___ 。
(4)有同学将SO2和Cl2按1:1同时通入到品红溶液中,发现褪色效果并不明显。可能的原因是___ (用化学方程式表示),设计实验证明上述原因___ 。

(1)图中盛放浓盐酸仪器的名称为
(2)反应一段时间后,B、D中品红褪色。反应结束后,分别加热B、D中的试管,可观察到的现象为:B
(3)C装置的作用是吸收尾气,写出SO2与足量NaOH溶液反应的离子方程式:
(4)有同学将SO2和Cl2按1:1同时通入到品红溶液中,发现褪色效果并不明显。可能的原因是
您最近一年使用:0次
2020-01-09更新
|
161次组卷
|
2卷引用:江苏省连云港市2018-2019学年高一上学期期末考试化学试题
5 . 某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示:______ 。
(2)实验时将B装置中的铜丝插入稀硝酸中,请写出B中反应的化学方程式_______ 。
(3)推动注射器,将F中空气通入E中,可观察到的现象是______ ,据此可以说明铜与稀硝酸反应产生的是NO气体,E中发生反应的化学方程式为______ 。
(4)该课外活动小组还进行了有关Cu、稀硝酸、稀硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是______ 。
b.NO是一种无色无味的气体,因此可以直接排放到空气中
c.实验③中滴加稀硫酸后,能观察到试管口有红棕色气体产生
d.由上述实验可得出结论:Cu在常温下既可与稀硝酸反应,又可与稀硫酸反应
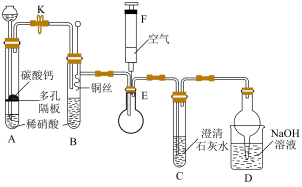
(2)实验时将B装置中的铜丝插入稀硝酸中,请写出B中反应的化学方程式
(3)推动注射器,将F中空气通入E中,可观察到的现象是
(4)该课外活动小组还进行了有关Cu、稀硝酸、稀硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
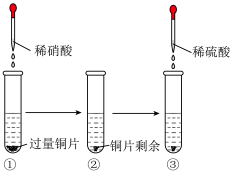
b.NO是一种无色无味的气体,因此可以直接排放到空气中
c.实验③中滴加稀硫酸后,能观察到试管口有红棕色气体产生
d.由上述实验可得出结论:Cu在常温下既可与稀硝酸反应,又可与稀硫酸反应
您最近一年使用:0次



